│§ųą╗»īW(xu©”)╦ßēA¹}Ą─Å═(f©┤)┴Ģ(x©¬)╝░ųž³cŅ}ą═ĮŌ╬÷
į┌Ė„╩Ī╩ąųą┐╝įćŠĒĄ─├³Ņ}ųą��Ż¼¤o▓╗īó╦ßēA¹}Ą─╗»īW(xu©”)ąį┘|(zh©¼)Ą─┐╝▓ņū„×ķųžųąų«ųž�ĪŻŲõŅ}ą═ų«ČÓūā╗»ų«┤¾Ż¼ī”ė┌═¼īW(xu©”)éāüĒųv┤_ėąŪ¦Ņ^╚fŠw�Īó┴”▓╗Å─ą─ų«Ėą���Ī���Ż╗∙ė┌┤╦Ż¼╣Pš▀ĮY(ji©”)║ŽĮ╠īW(xu©”)īŹ█`£\šäę╗Ž┬ėąĻP(gu©Īn)╦ßēA¹}Ą─Å═(f©┤)┴Ģ(x©¬)�����Ż¼ęįŲ┌ī”═¼īW(xu©”)éāĄ─Å═(f©┤)┴Ģ(x©¬)ėą╦∙ų·ęµ����ĪŻ
ę╗���Īó╩ņŠÜėøæøęÄ(gu©®)┬╔╩Ūæ¬(y©®ng)ė├Ą─Ū░╠ß
╦ßēA¹}▓┐Ęųļm╚╗Ņ}ą═▒ŖČÓŻ¼╚ńŻ║Ķbäe�Īó═ŲöÓĪó│²ļs……��Ż¼Ą½╩Ū▀@ą®æ¬(y©®ng)ė├ļx▓╗ķ_ūŅ╗∙ĄA(ch©│)Ą─ų¬ūR³cŻ║╝┤Ż║ī”╦ßēA¹}╗»īW(xu©”)ąį┘|(zh©¼)Ą─╩ņŠÜėøæø�����ĪŻ
═©▀^īW(xu©”)┴Ģ(x©¬)┐╔ų¬Ż║╦ߥ─═©ąįėą╬Õ³c�ĪóēA║═¹}Ą─═©ąįĖ„ėą╦─³cĪŻī”ė┌▀@ą®╗»īW(xu©”)ąį┘|(zh©¼)▒žĒÜ╝ėęįÅŖ╗»ėøæø║═ņ`╗Ņėøæø��Ī�����Ż┐╔▓╔ė├łD▒ĒėøæøĘ©ęį╝░ūā╩ĮėøæøĘ©Ą╚��ĪŻ
╚ńŻ║īó╦ßēA¹}Ą─╗»īW(xu©”)ąį┘|(zh©¼)ØŌ┐s×ķŽ┬łDėøæø▌^║├(łD▒ĒėøæøĘ©)

į┌┤╦╗∙ĄA(ch©│)╔Ž��Ż¼į┘ū÷ūā╩ĮŠÜ┴Ģ(x©¬)���Ż¼į÷╝ėī”╗»īW(xu©”)ąį┘|(zh©¼)Ą─ČÓĮŪČ╚ėøæø(ūā╩ĮėøæøĘ©)�ĪŻ╚ńŻ║
(1)╔·│╔¹}║═╦«Ą─ęÄ(gu©®)┬╔Ż¼ę╗Č©╩Ūųą║═Ę┤æ¬(y©®ng)åß?
(2)į┌╦ßēA¹}Ą─╗»īW(xu©”)ąį┘|(zh©¼)ųą����Ż¼╔·│╔¹}Ą─ęÄ(gu©®)┬╔ėąÄūŚlĄ╚ĪŻ
═©▀^╚ń╔ŽŠÜ┴Ģ(x©¬)���Ż¼╝┤┐╔ŲĄĮ╝ėÅŖų¬ūRĄ─═¼╗»║═«É╗»Ą─ū„ė├�ĪŻ
Č■��ĪóšŲ╬š“ęÄ(gu©®)Šž”���Ż¼┐╔│╔“ĘĮłA”
ėøæøūĪęį╔ŽęÄ(gu©®)┬╔Š═┐╔ęį╩ņŠÜæ¬(y©®ng)ė├┴╦åß?«ö(d©Īng)╚╗▓╗─▄����ĪŻį┌┤¾┴┐ŠÜ┴Ģ(x©¬)ųą═¼īW(xu©”)éā░l(f©Ī)¼F(xi©żn)ęį╔ŽęÄ(gu©®)┬╔ųąėą║▄ČÓ╩Ūėą “ęÄ(gu©®)Šž” ėąŚl╝■Ą─�����ĪŻę“┤╦į┌ėøūĪęÄ(gu©®)┬╔Ą─Ū░╠ߎ┬���Ż¼▀Ćę¬ėøūĪęÄ(gu©®)┬╔æ¬(y©®ng)ė├Ą─Śl╝■�����Ż¼▀@śė▓┼─▄ū÷ĄĮėąĄ─Ę┼╩ĖĄ─æ¬(y©®ng)ė├����ĪŻ▒╚╚ńŻ║┐╔Ė∙ō■(j©┤)▓╗═¼Ę┤æ¬(y©®ng)ŅÉą═üĒņ`╗ŅėøæøėąĻP(gu©Īn)Ę┤æ¬(y©®ng)Ą─Śl╝■�ĪŻÜw╝{╚ńŽ┬Ż║
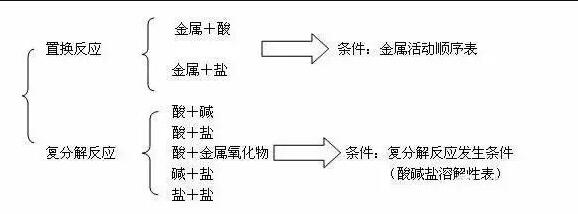
└²╚ńŻ║īæ│÷Ž┬┴ą╬’┘|(zh©¼)ųąā╔ā╔ų«ķg─▄░l(f©Ī)╔·Ę┤æ¬(y©®ng)Ą─╗»īW(xu©”)ĘĮ│╠╩ĮĪŻ
ĶF�����Īóč§╗»ĶF��Īó¤²ēA╚▄ę║�����ĪóŽĪ┴“╦ß�����Īó┴“╦ßŃ~╚▄ę║�Īó┬╚╗»õ^╚▄ę║ĪóČ■č§╗»╠╝
╦╝┬Ę³cō▄Ż║
┤╦ŅÉŅ}─┐╩Ū┐╝▓ņ╦ßĪóēA���Īó¹}�Īóč§╗»╬’ų«ķgĘ┤æ¬(y©®ng)ęÄ(gu©®)┬╔║═Ę┤æ¬(y©®ng)░l(f©Ī)╔·Śl╝■Ą─▌^║├ĘČ└²�ĪŻĮŌŅ}ĢrŻ¼×ķĘ└ų╣«a(ch©Żn)╔·üG┬õ¼F(xi©żn)Ž¾����Ż¼┐╔▓╔ė├ęįĶF×ķŲ³cų┤╬Ž“║¾čė╔ņ┼ąöÓĘ┤æ¬(y©®ng)╩Ūʱ░l(f©Ī)╔·Ż¼į┘ęįč§╗»ĶF×ķą┬Ų³cų┤╬Ēś═Ų……Ą─ĘĮĘ©�����ĪŻĮø(j©®ng)┼ąöÓ╣▓░l(f©Ī)╔·8éĆĘ┤æ¬(y©®ng)�ĪŻė╔ęį╔Ž┐╔ęį┐┤│÷Ż║į┌┼ąöÓĄ─▀^│╠ųąŻ¼ūį╚╗ÅŖ╗»┴╦ėąĻP(gu©Īn)Ę┤æ¬(y©®ng)ęÄ(gu©®)┬╔ęį╝░Ę┤æ¬(y©®ng)░l(f©Ī)╔·Śl╝■Ą─ėøæø��ĪŻ▀@śėĄ─┴Ģ(x©¬)Ņ}═¼īW(xu©”)éā┐╔ČÓšęę╗ą®�Ż¼ū÷│╔┐©Ų¼│Żéõū¾ėęŻ¼ļSĢr╝ėęįŠÜ┴Ģ(x©¬)��Ż¼╣”ĄĮūį╚╗│╔�ĪŻ
╚²���Īóūźųž³cŅ}ą═����Ż¼īW(xu©”)Ģ■ęį³cĦ├µ
į┌Å═(f©┤)┴Ģ(x©¬)ųąĮø(j©®ng)│ŻęŖĄĮ▓╗╔┘═¼īW(xu©”)┬±Ņ^ė┌Ņ}║Żų«ųąŻ¼║─ĢrķL╩šą¦╔§╬ó����ĪŻ╦ßēA¹}▓┐ĘųĄ─Ņ}ą═ļmą╬╩ĮČÓśėŻ¼Ą½╚fūā▓╗ļxŲõū┌����ĪŻŠC║Žų«Ž┬Ż¼┐╔ęįšfĶbäe�����Īó│²ļs���Īó═ŲöÓ▀@╚²ŅÉŅ}ą═╩Ū║▄Š▀┤·▒ĒąįĄ─�����Ż¼╦³éāĄ─š²┤_└ĒĮŌ║═šŲ╬š�����Ż¼ī”ė┌╠ßĖ▀Ųõ╦¹ŽÓĻP(gu©Īn)Ņ}ą═Ą─æ¬(y©®ng)ūā─▄┴”�����Ż¼▒žīóŲĄĮ║▄║├Ą─▌Ś╔õū„ė├�����ĪŻŽ┬├µĮY(ji©”)║ŽŽÓĻP(gu©Īn)└²Ņ}║åę¬Üw╝{ę╗Ž┬Ė„ūį╠ž³c�����ĪŻ
└²ę╗Ż║Ęųäe▀xė├ę╗ĘNįćä®ĶbäeęįŽ┬Ė„ĮM╚▄ę║Ż║
A NaOH�ĪóNaCl╚▄ę║ĪóŽĪHCl ()
B Na2CO3�����ĪóAgNO3╚▄ę║����ĪóKNO3╚▄ę║ ()
C K2CO3ĪóBaCl2╚▄ę║�ĪóNaCl╚▄ę║ ( )
D NaOHĪóCa(OH)2╚▄ę║��ĪóŽĪHCl ( )
E NH4NO3Īó(NH4)2SO4����ĪóNa2CO3�����ĪóNaCl╚▄ę║ ( )
╦╝┬Ę³cō▄Ż║
ĶbäeŅ}Ą─įŁät╩ŪŻ║ūźūĪ▓╗═¼╬’┘|(zh©¼)Ą─ų„ę¬╠žš„�����Ż¼ė├ūŅ║åå╬Ą─ĘĮĘ©���Ż¼ūŅ╔┘Ą─įćä®�����Ż¼ęįūŅ├„’@Ą─¼F(xi©żn)Ž¾��Ż¼▀_ĄĮĶbäeĄ──┐Ą─����ĪŻ╦∙ų^ūŅ║åå╬Ą─ĘĮĘ©╩ŪųĖ─▄ė├╬’└ĒĘĮĘ©ĶbäeĄ─Š═▓╗ę¬ė├╗»īW(xu©”)ĘĮĘ©Ķbäe;─▄ę╗┤╬ĶbäeĄ─Š═▓╗ė├ČÓ┤╬Ķbäe�ĪŻ╦∙ų^ūŅ╔┘įćä®�Ż¼Š═╩Ū─▄ė├ę╗ĘNįćä®Ķbäeķ_üĒĄ─Š═▓╗ę¬ė├ČÓĘNįćä®����ĪŻ╦∙ų^ūŅ├„’@Ą─¼F(xi©żn)Ž¾Ż¼Š═╩Ū═©▀^īŹ“×╩╣Ė„Ķbäe╬’┘|(zh©¼)ėą├„’@▓╗═¼Ą─¼F(xi©żn)Ž¾���ĪŻ╚ńŻ║«a(ch©Żn)╔·ūā╔½�����ĪóĘ┼│÷ÜŌ¾w�����Īó╔·│╔│┴ĄĒĄ╚���ĪŻ
ĮŌ╬÷Ż║AĪó═©▀^╬’┘|(zh©¼)ĘųŅÉ���Ż¼’@╚╗ę└┤╬Ę¹║ŽēAąį��Īóųąąį���Īó╦ßąį�Ż¼«ö(d©Īng)╚╗╝ė╩»╚’įćę║Ķbäe���ĪŻ
B�Īó ═©▀^ė^▓ņ░l(f©Ī)¼F(xi©żn)Ż║Na2CO3ė÷╦ß(H+)«a(ch©Żn)╔·ÜŌ¾w��Ż¼Č°AgNO3ė÷CL-«a(ch©Żn)╔·│┴ĄĒ�Ż¼Č°KNO3ė÷¹}╦ߤo¼F(xi©żn)Ž¾��Ż¼╣╩╝ė¹}╦ßüĒĶbäe�ĪŻ
CĪóė╔╔Ž┐╔ų¬Ż║K2CO3ė÷╦ß(H+)«a(ch©Żn)╔·ÜŌ¾w���Ż¼BaCl2╚▄ę║ė÷SO42-ėą│┴ĄĒ����Ż¼Č°NaCl╚▄ę║ė÷ŽĪ┴“╦ߤo¼F(xi©żn)Ž¾�����Ż¼╣╩╝ėŽĪ┴“╦ßüĒĶbäe��ĪŻ
D���ĪóCa(OH)2╚▄ę║ė÷CO32-ėą│┴ĄĒ�Ż¼ŽĪHCl ė÷CO32-ėąÜŌ¾wŻ¼Č°NaOH ė÷CO32-¤o├„’@¼F(xi©żn)Ž¾����Ż¼╣╩╝ėNa2CO3╗“K2CO3ĶbäeĪŻ
E���Īóė^▓ņ┐╔ų¬Ż║NH4+ė÷OH-«a(ch©Żn)╔·░▒ÜŌ����Ż¼Č°Ba2+ė÷CO32-����ĪóSO42-Š∙ėą│┴ĄĒ«a(ch©Żn)╔·Ż¼╚Īśė║¾ĘųäeĄ╬╝ėBa(OH)2╚▄ę║�Ż¼ų╗ėąÜŌ¾w«a(ch©Żn)╔·Ą─╩ŪNH4NO3Ż¼═¼ĢrėąÜŌ¾w║═│┴ĄĒ«a(ch©Żn)╔·Ą─╩Ū(NH4)2SO4����Ż¼ų╗ėą│┴ĄĒ«a(ch©Żn)╔·Ą─╩ŪNa2CO3Ż¼¤o¼F(xi©żn)Ž¾Ą─╩ŪNaCl���ĪŻ
į┌īŹļHæ¬(y©®ng)ė├ųą�����Ż¼═¼īW(xu©”)éā▀Ć┐╔ęįīóĶbäeŅ}░┤ę╗┤╬ąįĶbäe��ĪóČÓ┤╬ąįĶbäe�Īó▓╗╝ėŲõ╦¹įćä®ĶbäeĪóā╔ā╔╗ņ║ŽĶbäeĄ╚▀MąąĘųŅÉ�����Ż¼Ė∙ō■(j©┤)Ė„ūį¬ÜėąĄ─╠ž³c��Ż¼┐éĮY(ji©”)ĮŌŅ}╝╝Ū╔�Ż¼Å─Č°▀_ĄĮ╚½├µšŲ╬š▓╗═¼ĶbäeŅÉą═Ą──┐Ą─�ĪŻ
└²Č■Ż║▀xė├║Ž▀mĄ─ĘĮĘ©│²╚źŽ┬┴ą╬’┘|(zh©¼)ųąĄ─╔┘┴┐ļs┘|(zh©¼)
(1)│²╚ź╔·╩»╗ęųąĄ─╠╝╦ßŌ}
(2)│²╚ź┬╚╗»ŌøŠ¦¾wųąĄ─╠╝╦ßŌø
(3)│²╚ź╠╝╦ßŌ}╣╠¾wųąĄ─╠╝╦ßŌc
(4)│²╚źę╗č§╗»╠╝ųąĄ─Č■č§╗»╠╝
(5)│²╚ź┬╚╗»Ōc╚▄ę║ųąĄ─┴“╦ßŃ~
(6)│²╚źCuĘ█ųąĄ─FeĘ█
╦╝┬Ę³cō▄Ż║
│²ļsĄ─įŁät╩ŪŻ║▓╗į÷(▓╗į÷╝ėą┬ļs┘|(zh©¼))Īó▓╗£p(▓╗£p╔┘įŁ╬’┘|(zh©¼)Ą─┴┐)���Īó▓╗ūā(▓╗Ė─ūāįŁ╬’┘|(zh©¼)ĀŅæB(t©żi))�����ĪóęūĘų(│²ļs║¾ęūė┌Ęųļx)��ĪóŽ╚╬’║¾╗»(╬’└ĒĘĮĘ©ā×(y©Łu)Ž╚��Ż¼Ųõ┤╬╗»īW(xu©”)ĘĮĘ©)�����ĪŻæ¬(y©®ng)ė├ųąėą▐D(zhu©Żn)╗»Ę©���Īó│┴ĄĒĘ©�����Īó╬³╩šĘ©����Īó▀^×VĘ©����Īó╚▄ĮŌĘ©Ą╚ČÓĘN│²ļsĘĮĘ©ĪŻ
ĮŌ╬÷Ż║(1)═©▀^Ė▀£ž╝ė¤ß╗“ūŲ¤²Ą─ĘĮĘ©��Ż¼╝╚─▄│²╚ź╠╝╦ßŌ}����Ż¼ėų─▄Ą├ĄĮĖ³ČÓ╔·╩»╗ęĪŻ
(2)┐╔╝ė╚ļ▀m┴┐ŽĪ¹}╦ß│õĘųĘ┤æ¬(y©®ng)║¾Ż¼į┘š¶░l(f©Ī)���ĪŻ
(3)┐╔▓╔ė├Ž╚╝ė▀m┴┐╦«╚▄ĮŌ�����Ż¼į┘▀^×VĄ─ĘĮĘ©��ĪŻ
(4)┐╔▓╔ė├═©▀^¤ļ¤ßĄ─╠╝īė╗“═©▀^¤²ēA╚▄ę║Ą─ĘĮĘ©����ĪŻĄ½’@╚╗═©▀^¤²ēA╚▄ę║Ą─ĘĮĘ©Š▀ėą╬³╩šļs┘|(zh©¼)ÅžĄū����Īó▓┘ū„║åå╬┐ņĮ▌Ą╚ā×(y©Łu)³c��ĪŻ
(5)ė╔ė┌║¼ėąCu2+�ĪóSO42-ā╔ĘNļs┘|(zh©¼)ļxūėŻ¼╣╩┐╔▓╔ė├═¼Ģr│┴ĄĒĘ©�����ĪŻ╝ė╚ļ▀m┴┐Üõč§╗»õ^╚▄ę║║¾���Ż¼▀^×V╝┤┐╔Ą├┬╚╗»Ōc╚▄ę║�����ĪŻ
(6)ė╔ė┌Fe�����ĪóCuĘųäe┼┼į┌Įī┘╗ŅäėĒśą“▒ĒųąHĄ─Ū░║¾�Ż¼╦∙ęį┐╔▓╔ė├╝ė╚ļūŃ┴┐ŽĪ¹}╦ß╗“ŽĪ┴“╦ß╚▄ĮŌ▓ó▀^×VĄ─ĘĮĘ©üĒīŹ¼F(xi©żn)ĪŻę▓┐╔▓╔ė├╝ėūŃ┴┐┴“╦ßŃ~╚▄ę║▓ó▀^×VĄ─ĘĮĘ©��ĪŻ
└²╚²���Īóėąę╗╣╠¾w╗ņ║Ž╬’����Ż¼┐╔─▄║¼ėąK2CO3����ĪóK2SO4ĪóCuSO4��ĪóCaCl2�ĪóKNO3Ą╚╬’┘|(zh©¼)ųąĄ─ę╗ĘN╗“ÄūĘN��Ż¼īó╗ņ║Ž╬’╚▄ė┌╦«��Ż¼Ą├¤o╔½╚▄ę║�Ż¼«ö(d©Īng)?sh©┤)╬╚ļŽ§╦ßõ^╚▄ę║Ģr����Ż¼ėą░ū╔½│┴ĄĒ«a(ch©Żn)╔·Ż¼į┘╝ėūŃ┴┐Ą─ŽĪŽ§╦ß│┴ĄĒ▓┐Ęų╚▄ĮŌ�Ż¼ätįō╗ņ║Ž╬’ųąę╗Č©║¼ėą____________ę╗Č©▓╗║¼ėą_______________┐╔─▄║¼ėą_____________.
╦╝┬Ę³cō▄Ż║
═ŲöÓŅ}╦∙ė├ĄĮĄ─ų¬ūRā”éõėą╚ńŽ┬Äū³cŻ║(1)╬’┘|(zh©¼)Ą─╠ž╩Ō╔½æB(t©żi)Īó╚▄ĮŌąį(░³└©╬’┘|(zh©¼)į┌╦«╗“╦ßųąĄ─╚▄ĮŌąį)�ĪŻ╚ńŻ║Ń~ļxūė╚▄ę║×ķ╦{╔½Ż¼ĶFļxūė╚▄ę║×ķ³S╔½Ą╚���Ż¼│ŻęŖ░ū╔½│┴ĄĒėą╠╝╦ßŌ}��Īó╠╝╦ßõ^�Īó╠╝╦ßŃy���Īó┬╚╗»ŃyĪó┴“╦ßõ^��ĪóÜõč§╗»µVĄ╚����ĪŻ╦{╔½│┴ĄĒėąÜõč§╗»Ń~�����Ż¼╝t║ų╔½│┴ĄĒėąÜõč§╗»ĶF���ĪŻ│§ųą▓╗╚▄ė┌╦ߥ─│┴ĄĒėą┬╚╗»ŃyĪó┴“╦ßõ^��ĪŻ(2)Ģ■┼ąöÓ╬’┘|(zh©¼)ų«ķg─▄ʱ░l(f©Ī)╔·Ę┤æ¬(y©®ng)�ĪŻ(3)╚²ĘNļxūė(┴“╦ßĖ∙Īó╠╝╦ßĖ∙�Īó┬╚ļxūė)ĶbČ©Ą─š²─µ═Ų└ĒĪŻ(4)ī”ė┌ųž³cį~šZĄ─└ĒĮŌ─▄┴”��ĪŻ╚ńŻ║“╚½▓┐╚▄”��Īó“▓┐Ęų╚▄”�����Īó“╚½▓╗╚▄”Ą╚į~Ą─└ĒĮŌ���ĪŻę╗Ą└║├Ą─═ŲöÓŅ}š²╩Ūī”ė┌ęį╔Žų¬ūR³cšŲ╬š│╠Č╚Ą─ŠC║Žąį┐╝▓ņ����ĪŻ
ĮŌ╬÷Ż║═ŲöÓŅ}Ą─ĮŌ┤ę└ō■(j©┤)╩Ū╬’┘|(zh©¼)Ą─╠žš„Ę┤æ¬(y©®ng)║═Ąõą═Ą─īŹ“×¼F(xi©żn)Ž¾ĪŻ┤╦Ņ}ė╔╚▄ė┌╦«Ą├ĄĮ“¤o╔½╚▄ę║”┐╔ų¬Ż║CuSO4(╦{╔½╚▄ę║)ę╗Č©▓╗┤µį┌;═¼ĢrK2CO3�ĪóCaCl2ė╔ė┌ŽÓė÷Ģ■«a(ch©Żn)╔·│┴ĄĒŻ¼╦∙ęįK2CO3����ĪóCaCl2╗“┤µŲõę╗╗“Š∙▓╗┤µį┌ĪŻė╔“Ą╬╝ėŽ§╦ßõ^╚▄ę║Ģr�����Ż¼ėą░ū╔½│┴ĄĒ«a(ch©Żn)╔·”┐╔ų¬Ż║│┴ĄĒėą┐╔─▄üĒūįŽ§╦ßõ^┼cK2CO3╗“K2SO4Ę┤æ¬(y©®ng)╔·│╔Ą─╠╝╦ßõ^�Īó┴“╦ßõ^│┴ĄĒųąĄ─ę╗š▀╗“ā╔š▀ĪŻė╔“╝ėūŃ┴┐Ą─ŽĪŽ§╦ß│┴ĄĒ▓┐Ęų╚▄ĮŌ”┐╔ų¬Ż║╠╝╦ßõ^�Īó┴“╦ßõ^Š∙┤µį┌Ż¼▀MČ°═Ų│÷K2CO3�����ĪóK2SO4Š∙┤µį┌�����ĪŻę“×ķK2CO3┤µį┌���Ż¼╦∙ęįCaCl2ę╗Č©▓╗┤µį┌��ĪŻČ°KNO3ė╔ė┌┤µį┌┼cʱ����Ż¼Š∙▓╗Ģ■ī”ęį╔ŽĶbäe═ŲöÓįņ│╔ė░Ēæ�����Ż¼╦∙ęįKNO3┐╔─▄┤µį┌���Ż¼ę▓┐╔ęįšf┐╔─▄▓╗┤µį┌���ĪŻ
┤╦Ņ}Ż¼į┌ŠÜ┴Ģ(x©¬)▀^│╠ųą��Ż¼═Ļ╚½┐╔ęį┬į╝ėĖ─äė��ĪŻ╚ńŻ║╚¶“│┴ĄĒ╚½▓┐╚▄ĮŌ”═ŲöÓĮY(ji©”)╣¹į§śė?╚¶“│┴ĄĒ╚½▓╗╚▄”═ŲöÓĮY(ji©”)╣¹ėųĢ■į§śė?……�����ĪŻ═¼īW(xu©”)éāę╗Ą®šŲ╬š┴╦▀@ĘNę╗Ņ}ČÓūā��Īóę╗Ņ}ČÓū÷Ą─īW(xu©”)┴Ģ(x©¬)ĘĮĘ©Ż¼ī”ė┌╠ßĖ▀Å═(f©┤)┴Ģ(x©¬)ą¦╣¹▒ž╚╗┐╔ęįŲĄĮęį³cĦ├µĄ─▌Ś╔õū„ė├�ĪŻ
ĪĪĪĪ ÜgėŁ╩╣ė├╩ųÖCĪóŲĮ░ÕĄ╚ęŲäėįO(sh©©)éõįLå¢ųą┐╝ŠW(w©Żng)�Ż¼2023ųą┐╝ę╗┬Ę┼Ń░ķ═¼ąąŻĪ>>³cō¶▓ķ┐┤










