╚▄ę║Ą─╦ßēAąį
ę╗Īó╦ßąį╚▄ę║║═ēAąį╚▄ę║
1.╦ßąį╚▄ę║�ĪóēAąį╚▄ę║║═ųĖ╩Šä®Ą─Ę┤æ¬Ż║
|
īŹ“×įćśė |
░ū┤ū |
╦ß╣¹ųŁ |
ŽĪ¹}╦ß |
╝āēA╚▄ę║ |
Ę╩įĒ╦« |
╩»╗ę╦« |
░▒╦« |
╩│¹}╦« |
šß╠Ū╦« |
|
Ą╬╝ėūŽ╔½╩»╚’įćę║ |
ūā╝t |
ūā╝t |
ūā╝t |
ūā╦{ |
ūā╦{ |
ūā╦{ |
ūā╦{ |
ūŽ╔½ |
ūŽ╔½ |
|
Ą╬╝ė¤o╔½Ęė╠¬įćę║ |
¤o╔½ |
¤o╔½ |
¤o╔½ |
ūā╝t |
ūā╝t |
ūā╝t |
ūā╝t |
¤o╔½ |
¤o╔½ |
|
ĮYšō |
╦ßąį |
╦ßąį |
╦ßąį |
ēAąį |
ēAąį |
ēAąį |
ēAąį |
ųąąį |
ųąąį |
ĮYšōŻ║
(1)Ę▓╩Ū─▄╩╣ūŽ╔½╩»╚’įćę║ūā╝tĄ─╚▄ę║Č╝╩Ū╦ßąį╚▄ę║��Ż¼Ūęįō╚▄ę║▓╗─▄╩╣¤o╔½Ęė╠¬įćę║ūā╔½;
(2)Ę▓╩Ū─▄╩╣ūŽ╔½╩»╚’įćę║ūā╦{Ą─╚▄ę║Č╝╩ŪēAąį╚▄ę║�����Ż¼▓óŪęįō╚▄ę║─▄╩╣¤o╔½Ęė╠¬įćę║ūā╝t;
(3)▓╗─▄╩╣ūŽ╔½╩»╚’įćę║ūā╔½���Ż¼ę▓▓╗─▄╩╣¤o╔½Ęė╠¬įćę║ūā╔½Ą─╚▄ę║Ż¼╬ęéāĘQ×ķųąąį╚▄ę║;
(4)ūŽ╔½╩»╚’įćę║║═Ęė╠¬─▄Öz“×╚▄ę║╦ßēAąįĄ─įćä®����Ż¼╬ęéāĘQ×ķ╦ßēAųĖ╩Šä®ĪŻ
ūóęŌŻ║
ó┘╦ßąį╚▄ę║─▄╩╣╦{╔½╩»╚’įć╝łūā╝t�Ż¼ēAąį╚▄ę║─▄╩╣╝t╔½╩»╚’įć╝łūā╦{;
ó┌ų╗ėą┐╔╚▄ąįĄ─╦ßąįĪóēAąį╬’┘|(zh©¼)▓┼─▄╩╣ųĖ╩Šä®ūā╔½�����Ż¼ūā╔½Ą─╩ŪųĖ╩Šä®���Ż¼Č°▓╗╩Ūįō╬’┘|(zh©¼)�Ż¼Č°Ūę▀@╦ßēA║═ųĖ╩Šä®Ą─Ę┤æ¬ī┘ė┌╗»īWūā╗»�ĪŻ
2.╚š│Ż╔·╗Ņųą│ŻęŖĄ─╦ßąį╬’┘|(zh©¼)┼cēAąį╬’┘|(zh©¼)
(1)╦ßąį╬’┘|(zh©¼)Ż║╔Įķ½ĪóÖÄ├╩��ĪóĖ╠ķ┘Īó╬„╝t╩┴�����Ż¼╩│┤ūĄ╚;
(2)ēAąį╬’┘|(zh©¼)Ż║╩ņ╩»╗ę�Ż¼╠╝╦ßŌcĄ╚ĪŻ
3.ģ^(q©▒)Ęų╦ß╚▄ę║║═╦ßąį╚▄ę║���ĪóēA╚▄ę║║═ēAąį╚▄ę║
ūóęŌŻ║╦ß╚▄ę║╩ŪųĖ╦ߥ─╦«╚▄ę║�Ż¼╦ßąį╚▄ę║╩ŪųĖ─▄╩╣ūŽ╔½╩»╚’įćę║ūā╝tĄ─╚▄ę║�Ż¼ę“┤╦╦ß╚▄ę║ę╗Č©╩Ū╦ßąį╚▄ę║Ż¼Č°╦ßąį╚▄ę║▓╗ę╗Č©╩Ū╦ß╚▄ę║;═¼śė����Ż¼ēAąį╚▄ę║▓╗ę╗Č©╩ŪēA╚▄ę║Ż¼ēA╚▄ę║ę╗Č©╩ŪēAąį╚▄ę║���ĪŻ
└²╚ńŻ║┴“╦ßŃ~��Īó┬╚╗»õ@�����Ż¼┴“╦ßÜõŌcĄ─╦«╚▄ę║’@╦ßąį�Ż¼Č°▓╗╩Ū╦ß;╝āēAĪóĘ╩įĒĄ─╦«╚▄ę║’@ēAąį���Ż¼Ą½▓╗╩ŪēAĪŻ
4.╦ß��ĪóēA�����Īó¹}Ą─Ė┼─Ņ
(1)╦߯║ļŖļxĢr╔·│╔Ą─Ļ¢ļxūė╚½▓┐╩ŪÜõļxūėĄ─╗»║Ž╬’���ĪŻ╚ńŻ║HCl����ĪóHNO3���ĪóH2SO4���ĪóH2CO3Ą╚ĪŻ
HCl= H+ + Cl-(ę╗į¬╦ß);H2SO4= 2H++SO42-(Č■į¬╦ß);
(2)ēAŻ║ļŖļxĢr╔·│╔Ą─ĻÄļxūė╚½▓┐╩ŪÜõč§Ė∙ļxūėĄ─╗»║Ž╬’���ĪŻ╚ńŻ║NaOH����ĪóCa(OH)2Ą╚ĪŻ
NaOH = Na+ + OH-(ę╗į¬ēA);Ca(OH)2 = Ca2+ + 2OH-(Č■į¬ēA);
(3)¹}Ż║ļŖļxĢr╔·│╔Įī┘ļxūė(╗“õ@Ė∙ļxūė)║═╦ßĖ∙ļxūėĄ─╗»║Ž╬’���ĪŻ╚ńŻ║NaCl���ĪóNH4NO3Ą╚ĪŻ
NaCl = Na+ + Cl-; NH4NO3 = NH4+ + NO3-;
Č■�Īó╚▄ę║Ą─╦ßēAąįĄ─ÅŖ╚§
1.╦ßēAČ╚Ż║ė├üĒ▒Ē╩Š╚▄ę║Ą─╦ßąį╗“ēAąįĄ─ÅŖ╚§│╠Č╚ĪŻ
2.pHįć╝łė├üĒČ©┴┐Ą─£yČ©╚▄ę║Ą─╦ßēAČ╚���ĪŻ

╦ßąįį÷ÅŖ ųąąį ēAąįį÷ÅŖ
╚▄ę║Ą─pHųĄ┼c╦ßēAąįĻPŽĄ:
pH=7����Ż¼╚▄ę║│╩ųąąį;
pH<7��Ż¼╚▄ę║│╩╦ßąį��Ż¼ŪępHįĮąĪ���Ż¼╦ßąįįĮÅŖ;
pH>7�����Ż¼╚▄ę║│╩ēAąį����Ż¼ŪępHįĮ┤¾���Ż¼ēAąįįĮÅŖĪŻ
3.pHįć╝łĄ─╩╣ė├ĘĮĘ©:
ė├▓Ż┴¦░¶š║╚Ī┤²£y╚▄ę║��Ż¼Ą╬į┌PHįć╝ł╔Ž����Ż¼’@╔½║¾ī”ššś╦£╩▒╚╔½┐©���Ż¼ūx│÷ūxöĄ(sh©┤)��ĪŻ
ūóęŌŻ║
(1)▓╗─▄ų▒Įė░čpHįć╝łĮ■╚ļ┤²£y╚▄ę║ųą;
(2)▓╗─▄Ž╚ė├╦«īópHįć╝łØÖر���Ż¼į┘▀Mąą£yįćŻ¼ę“×ķ╦«ØÖر║¾Ą─pHįć╝łį┘Ą╬╚ļ┤²£yę║ŽÓ«öė┌▒╗ŽĪßī;
(3)īŹ“×╩ę╩╣ė├Ą─pHįć╝ł╩ŪÅVĘ║pHįć╝ł���Ż¼£y│÷Ą─pHųĄ╩Ū1~14Ą─š¹öĄ(sh©┤);
╚²���Īó╚▄ę║╦ßēAąį┼c╔·├³╗ŅäėĄ─ĻPŽĄ
1.╚╦Ą─¾wę║ėąę╗Č©Ą─╦ßēAČ╚��ĪŻč¬ę║���ĪóĮM┐Śķgę║║═╝Ü░¹ā╚(n©©i)ę║Ą─╦ßēAČ╚Č╝ĮėĮ³ė┌ųąąįŻ¼Č°Ūęūā╗»śOąĪ;
2.╬Ėę║Ą─pHį┌0.9~1.5ų«ķg����Ż¼╬Ėę║Ą─ų„ę¬│╔Ęų╩Ū¹}╦ßHCl;
3.┤¾ČÓöĄ(sh©┤)▐r(n©«ng)ū„╬’▀mę╦į┌ĮėĮ³ųąąį(pHį┌6.5~7.5ų«ķg)Ą─═┴╚└ųą╔·ķLŻ¼į┌Ė─┴╝╦ßąį═┴╚└Ģr����Ż¼╬ęéāę╗░Ń╩Ū╩╣ė├╩ņ╩»╗ęüĒš{(di©żo)╣Ø(ji©”)Ųõ╦ßēAČ╚;
4.ėĻ╦«ę╗░Ń│╩┬į╦ßąį(ė╔ė┌┐šÜŌųąĄ─Č■č§╗»╠╝╚▄ĮŌį┌ėĻ╦«ųą)Ż¼š²│ŻėĻ╦«Ą─PH≈5.6��Ż¼╚╦éāę╗░Ń░čpHąĪė┌5.6 Ą─ėĻ╦«ĘQ×ķ╦ßėĻ��ĪŻ
Ī÷│ŻęŖĄ─╦ß║═ēA
ę╗����Īó│ŻęŖĄ─╦ß
1.╔·╗Ņųą│Żė├Ą─╦߯║╬Ėę║ųą║¼ėąĄ─¹}╦ß(HCl)Ż¼ąŅļŖ│žųą║¼ėą┴“╦ß(H2SO4)����Ż¼╦ßėĻųą║¼ėąĄ─┴“╦ß╝░Ž§╦ß(HNO3)����Ż¼╩│┤ūųą║¼ėąĄ─┤ū╦ß(CH3COOH);’ŗ┴Žųą┐╔─▄║¼ėąĄ─╠╝╦ß�����ĪóÖÄ├╩╦ߥ╚���ĪŻ
2.ØŌ┴“╦ß���ĪóØŌ¹}╦ß║═ØŌŽ§╦ߥ─╬’└Ēąį┘|(zh©¼)
|
|
ØŌ┴“╦ß |
ØŌ¹}╦ß |
ØŌŽ§╦ß |
|
╚▄┘|(zh©¼)Ą─╗»īW╩Į |
H2SO4 |
HCl |
HNO3 |
|
Ņü╔½ |
¤o╔½ |
¤o╔½ |
¤o╔½ |
|
ĀŅæB(t©żi) |
š││Ē�����Īóė═ĀŅę║¾w |
ę║¾w |
ę║¾w |
|
ÜŌ╬Č |
¤o╬Č |
┤╠╝żąįÜŌ╬Č |
┤╠╝żąįÜŌ╬Č |
|
ØŌČ╚ |
98% |
36%~37% |
70% |
|
├▄Č╚Ż©┼c╦«▒╚▌^Ż® |
1.84g/mL |
1.17g/mL |
1.42g/mL |
|
│©ķ_įćä®Ų┐┐┌░l(f©Ī)╔·Ą─¼F(xi©żn)Ž¾ |
¤o├„’@¼F(xi©żn)Ž¾ |
«a(ch©Żn)╔·░ūņF |
«a(ch©Żn)╔·░ūņF |
|
╩ŪʱŠ▀ėąō]░l(f©Ī)ąį |
▓╗ęūō]░l(f©Ī) |
ėąō]░l(f©Ī)ąį |
ėąō]░l(f©Ī)ąį |
|
┼c╦«╗ņ║Ž |
Ę┼│÷┤¾┴┐Ą─¤ß |
¤o├„’@Ę┼¤ß |
¤o├„’@Ę┼¤ß |
|
┬Čų├į┌┐šÜŌųą║¾Ą─╚▄ę║┘|(zh©¼)┴┐ |
ūā┤¾ |
ūāąĪ |
ūāąĪ |
|
┬Čų├į┌┐šÜŌųą║¾Ą─╚▄┘|(zh©¼)┘|(zh©¼)┴┐ |
▓╗ūā |
ūāąĪ |
ūāąĪ |
|
┬Čų├į┌┐šÜŌųą║¾Ą─╚▄ä®┘|(zh©¼)┴┐ |
ūā┤¾ |
▓╗ūā |
▓╗ūā |
|
┬Čų├į┌┐šÜŌųą║¾Ą─┘|(zh©¼)┴┐ĘųöĄ(sh©┤) |
ūāąĪ |
ūāąĪ |
ūāąĪ |
ūóęŌŻ║ØŌ┴“╦ߊ▀ėąę╗Č©Ą─╠žąįŻ║
(1)╬³╦«ąį(╬’└Ēąį┘|(zh©¼))ė├ė┌ÜŌ¾wĖ╔į’�����Ż¼Ą½│²NH3Ą╚ēAąįÜŌ¾w│²═Ō���Ż¼ī”æ¬Ą─╗»īWĘĮ│╠╩Į×ķŻ║2NH3 + H2SO4 ==(NH4)2SO4;
(2)├ō╦«ąį(╗»īWąį┘|(zh©¼))—ØŌ┴“╦ß┼cšß╠ŪĘ┤æ¬���Ż¼╩╣ų«╠┐╗»;
(3)ÅŖč§╗»ąį��Ż¼Ė»╬gąį——┼cĮī┘░l(f©Ī)╔·Ę┤æ¬�Ż¼╔·│╔Ą─ÜŌ¾w▓╗╔·│╔ÜõÜŌČ°╩ŪČ■č§╗»┴“��ĪŻ
į┌ą┼ŽóŅ}─┐ųąéĆ���Ż¼ėąĢr║“╬ęéāĢ■ė÷ĄĮ▀@śėĄ─Ņ}─┐Ż║į┌╝ė¤ßĄ─Śl╝■Ž┬���Ż¼─▄┼c┼┼į┌Üõ║¾├µĄ─Įī┘(╚ńCu)Ę┤æ¬Ż¼╚ńŻ║
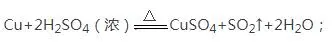
(4)ØŌ┴“╦ߥ─ŽĪßīŻ║╦ß╚ļ╦«��Ż¼čžŲ„▒┌��Ż¼öć░Ķ�ĪŻ
ØŌ┴“╦ß╚▄ė┌╦«Ę┼│÷┤¾┴┐Ą─¤ßŻ¼┐╔ęį╩╣╦«ĘųĘą“v�����ĪŻ╚ń╣¹░č╦«Ą╣╚ļØŌ┴“╦ßųą�Ż¼╦«Š═Ģ■ĖĪį┌ØŌ┴“╦ß╔Ž├µŻ¼╚▄ĮŌĢrĘ┼│÷┤¾┴┐Ą─¤ßų┬╩╣╦«Ęą“vČ°╩╣┴“╦ßę║Ą╬Ž“╦─ų▄’w×R���ĪŻ
(5)░▓╚½╩┬╣╩╠Ä└ĒŻ║ØŌ┴“╦ß×RĄĮŲż─w╔Ž║¾��Ż¼╩ūŽ╚čĖ╦┘ė├─©▓╝īóŲõ▓┴╩├�����Ż¼╚╗║¾ė├┤¾┴┐╦«ø_Ž┤���Ż¼ūŅ║¾ė├3%~5%Ą─NaHCO3═┐Ę¾���ĪŻ
4.╦ߥ─╗»īWąį┘|(zh©¼)
(1)īŹ“ׯ║ŽĪ┴“╦ßĪóŽĪ¹}╦ß����ĪóŽĪŽ§╦ß╗»īWąį┘|(zh©¼)Ą─▒╚▌^
┐éĮYŻ║
╦ß╦∙Š▀ėąĄ─╣▓═¼╠ž³cŻ║(╦ßį┌╦«╚▄ę║ųąČ╝─▄ļŖļx│÷ÜõļxūėŻ¼╣╩╦ß╚▄ę║Ģ■Š▀ėąįSČÓ╣▓═¼Ą─ąį┘|(zh©¼)��ĪŻ)
Č■��Īó╦ߥ─═©ąį(5Śl)Ż║
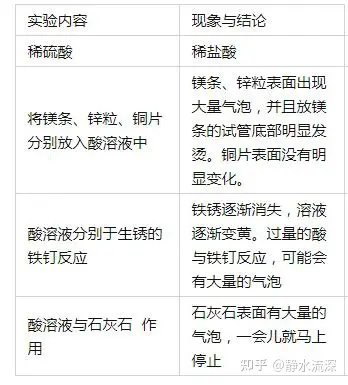
(1)╦ß╚▄ę║┼c╦ßēAųĖ╩Šä®Ą─Ę┤æ¬
A.ūŽ╔½╩»╚’įćę║ė÷ĄĮ╦ß╚▄ę║ūā╝t╔½;
B.¤o╔½Ęė╠¬įćä®ė÷ĄĮ╦ß╚▄ę║▓╗ūā╔½����ĪŻ
(2)╦ß+Įī┘=¹}+ÜõÜŌ(ų├ōQĘ┤æ¬)
╦ß╚▄ę║ + (ÜõŪ░)Įī┘ → ¹}╚▄ę║ + ÜõÜŌ
ūóęŌŻ║
A.į┌Įī┘╗ŅäėąįĒśą“▒Ēųą�����Ż¼┼┼į┌ÜõŪ░├µĄ─Įī┘─▄ų├ōQ│÷╦ßųąĄ─ÜõŻ¼┼┼į┌Üõ║¾├µĄ─Įī┘ät▓╗─▄;
B.┼┼į┌Įī┘╗ŅäėąįĒśą“▒ĒįĮŪ░├µĄ─Įī┘��Ż¼Ę┤欼F(xi©żn)Ž¾įĮäĪ┴ę�Ż¼╦┘Č╚įĮ┐ņŻ¼╚ńMgĘ┤æ¬ėą├„’@Ę┼
¤ß¼F(xi©żn)Ž¾;
C.ÅŖč§╗»ąį╦ß┼cĮī┘Ę┤æ¬║¾���Ż¼▓╗─▄╔·│╔ÜõÜŌ���Ż¼Č°╩Ū╔·│╔╦«ĪŻ╚ńØŌ┴“╦ß����ĪóŽ§╦ߥ╚ÅŖč§╗»ąį╦ß;
D.įōŅÉĘ┤æ¬ī┘ė┌ų├ōQĘ┤æ¬Ż¼╚ńŻ║
Zn + 2HCl = ZnCl2 + H2↑;
Fe + H2SO4 = FeSO4 + H2↑ .
(3)╦ß+Įī┘č§╗»╬’=¹}+╦«(Įī┘č§╗»╬’ėųĘQēAąįč§╗»╬’����Ż¼ī┘ė┌Å═ĘųĮŌĘ┤æ¬)
įōĘ┤æ¬▀^│╠ųąŻ¼Įī┘į¬╦žĄ─╗»║Žār▓╗ūā���Ż¼╦ßųąĄ─įŁūėłF▓╗ūā���Ż¼ ╚ńŻ║
CuO + 2HCl = CuCl2 + H2O;
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O;
ZnO + 2HNO3 == Zn(NO3)2+H2O;
į┌ę╗ą®┘Y┴Žęį╝░┐╝įćŅ}─┐«öųąŻ¼ę▓ėąŽ╚ĻPĄ─ų¬ūR��Ż¼┐╔ęį╠ßŪ░┴╦ĮŌŻ║
|
|
╦ßąįč§╗»╬’ |
ēAąįč§╗»╬’ |
|
Č©┴x |
Ę▓─▄┼cēAĘ┤æ¬╔·│╔¹}║═╦«Ą─č§╗»╬’┤¾ČÓöĄ(sh©┤)ĘŪĮī┘č§╗»╬’╩Ū╦ßąįč§╗»╬’┤¾ČÓöĄ(sh©┤)╦ßąįč§╗»╬’╩ŪĘŪĮī┘č§╗»╬’ĪŻ |
Ę▓─▄┼c╦ßĘ┤æ¬╔·│╔¹}║═╦«Ą─č§╗»╬’┤¾ČÓöĄ(sh©┤)Įī┘č§╗»╬’╩ŪēAąįč§╗»╬’╦∙ėąēAąįč§╗»╬’╩ŪĮī┘č§╗»╬’���ĪŻ |
|
╗»īWąį┘|(zh©¼) |
┤¾ČÓöĄ(sh©┤)┐╔┼c╦«Ę┤æ¬╔·│╔╦߯║CO2+H2O= H2CO3����Ż╗
SO2+H2O= H2SO3����Ż╗
SO3+H2O= H2SO4. |
╔┘öĄ(sh©┤)┐╔┼c╦«Ę┤æ¬╔·│╔ēAŻ║Na2O+H2O=2NaOHŻ╗K2O+H2O=2KOH��Ż╗BaO+H2O=Ba(OH)2���Ż╗CaO+H2O==Ca(OH)2. |
|
╦ßąįč§╗»╬’+ēA→¹}+╦«CO2+Ca(OH)2=CaCO3↓+H2O (▓╗╩ŪÅ═ĘųĮŌĘ┤æ¬) |
ēAąįč§╗»╬’+╦ß→¹}+╦«Fe2O3+6HCl=2FeCl3+3H2O(╩ŪÅ═ĘųĮŌĘ┤æ¬) |
(4) ╦ß + ēA= ¹} + ╦«(ėųĘQ×ķųą║═Ę┤æ¬�Ż¼Ę┤æ¬ŅÉą═Ż║Å═ĘųĮŌĘ┤æ¬)
ūóęŌŻ║ėą¹}║═╦«Ą─╔·│╔▓╗ę╗Č©╩Ūųą║═Ę┤æ¬��Ż¼╚ńCO2+Ca(OH)2=CaCO3↓+H2O ;
(5)╦ß+¹}=ą┬╦ß+ą┬¹}
ūóęŌŻ║
A.╬ęéā═©│Żė÷ĄĮĄ─¹}╩Ū╠╝╦ß¹}���Ż¼ę“┤╦Į^┤¾▓┐ĘųĘ┤æ¬╩ŪŻ║
╦ß + ╠╝╦ß¹} =ą┬¹} + ╦« + Č■č§╗»╠╝Ż¼ę└╚╗╩ŪÅ═ĘųĮŌĘ┤æ¬;
╚ńŻ║
CaCO3 + 2HCl =CaCl2 + H2O + CO2↑;
Na2CO3 + H2SO4 =Na2SO4 + H2O + CO2↑;
K2CO3 + 2HNO3 =2KNO3 + H2O + CO2↑;
MgCO3 + 2CH3COOH = (CH3COO)2Mg + H2O + CO2↑;
B.─│ą®╠ž╩ŌĄ─¹}─▄┼c╦ßĘ┤æ¬���Ż¼╔·│╔╠ž╩ŌĄ─│┴ĄĒ����Ż¼ąĶę¬ėøæø│┴ĄĒ
╚ńŻ║
HCl + AgNO3 == AgCl↓+ HNO3 ;
BaCl2 + H2SO4 == BaSO4↓+ 2HCl.
ča│õŻ║ Cl-╝░SO42-Ą─Öz“×
A.Ž“┤²£y╚▄ę║ųą╝ė╚ļAgNO3╚▄ę║║¾ėą░ū╔½│┴ĄĒ╔·│╔Ż¼Ą╬╚ļŽĪŽ§╦ß╚▄ę║║¾���Ż¼│┴ĄĒ▓╗Ž¹╩¦����Ż¼ät╚▄ę║ųą║¼ėąCl-��Ż¼╚ń╣¹ø]ėą│┴ĄĒ╗“š▀│┴ĄĒŽ¹╩¦�Ż¼ät▓╗║¼ėąCl-;
B.Ž“┤²£y╚▄ę║ųą╝ė╚ļBa(NO3)2╚▄ę║║¾ėą░ū╔½│┴ĄĒ╔·│╔Ż¼Ą╬╚ļŽĪŽ§╦ß╚▄ę║║¾���Ż¼│┴ĄĒ▓╗Ž¹╩¦�Ż¼ät╚▄ę║ųą║¼ėąSO42-���Ż¼╚ń╣¹ø]ėą│┴ĄĒ╗“š▀│┴ĄĒŽ¹╩¦�����Ż¼ät▓╗║¼ėąSO42-��ĪŻ
╚²�Īó│ŻęŖĄ─ēA
|
īŹ“×ā╚(n©©i)╚▌ |
īŹ“×¼F(xi©żn)Ž¾ |
|
Üõč§╗»ŌcĪóÜõč§╗»Ō}�����Īó░▒╦« ╬’└Ēąį┘|(zh©¼)Ą─▒╚▌^ |
├¹ĘQ |
Üõč§╗»Ōc |
Üõč§╗»Ō} |
░▒╦« |
|
╗»īW╩Į |
NaOH |
Ca(OH)2 |
NH3•H2O |
|
Ņü╔½ |
░ū╔½ |
░ū╔½ |
¤o╔½ |
|
ĀŅæB(t©żi) |
Ų¼ĀŅ╣╠¾w |
Ę█─®ĀŅ╣╠¾w |
ę║¾w |
|
ÜŌ╬Č |
¤o╬Č |
¤o╬Č |
ėą░▒│¶ÜŌ╬Č |
|
╚▄ĮŌąį |
ęū╚▄ |
╬ó╚▄ |
ęū╚▄ |
|
╦ūĘQ |
¤²ēA�����Īó╗ēA┐┴ąįŌc |
╩ņ╩»╗ęŽ¹╩»╗ę |
—— |
|
Üõč§╗»Ōc���Īó░▒╦« ┬Čų├į┌┐šÜŌųą░l(f©Ī)╔·Ą─ūā╗» |
╣╠¾wÜõč§╗»Ōc┬Čų├į┌┐šÜŌųą�����Ż¼▒Ē├µ│÷¼F(xi©żn)│▒ر��Ż¼▀@éĆ¼F(xi©żn)Ž¾ĘQ×ķ│▒ĮŌ��ĪŻ═¼ĢrÜõč§╗»Ōcę▓Ģ■╬³╩š┐šÜŌųąĄ─Č■č§╗»╠╝Č°┘|(zh©¼)ūā�����Ż¼╔·│╔╠╝╦ßŌc�����ĪŻ░▒╦«┬Čų├į┌┐šÜŌųą�����Ż¼Ģ■╩╣Ųõ╚▄┘|(zh©¼)┘|(zh©¼)┴┐ĘųöĄ(sh©┤)ūāąĪ���ĪŻ |
|
¤²ēAį┌╦«ųąĄ─╚▄ĮŌŪķør |
Ę┼│÷┤¾┴┐Ą─¤ßŻ¼╦«╚▄ę║Š▀ėą╗¼─üĖą��ĪŻ |
|
į┌┴“╦ßŃ~╚▄ę║ųąĄ╬╝ė╩»╗ę╦« |
│÷¼F(xi©żn)╦{╔½│┴ĄĒCuSO4+Ca(OH)2==Cu(OH)2↓+CaSO4↓ |
1.ėąĻPēAĄ─ę╗ą®ąį┘|(zh©¼)▒╚▌^
¤²ēAŠ▀ėąÅŖĖ»╬gąį�����Ż¼Üõč§╗»Ō}║═░▒╦«ę▓Š▀ėąę╗Č©Ą─Ė»╬gąį���ĪŻ
2.ēAĄ─╣▓═¼ąį┘|(zh©¼)(ė╔ė┌ēAļŖļx║¾Č╝─▄╔·│╔OH-�����Ż¼ę“┤╦ę▓Š▀ėąŽÓ═¼Ą─ąį┘|(zh©¼))
╦─��ĪóēAĄ─╦─┤¾═©ąįŻ║
╩ūŽ╚┴╦ĮŌ��Ż¼ēAĄ─ļŖļx�����Ż¼╚ńŻ║
NaOH = Na+ + OH-;
NH3•H2O = NH4+ + OH-(NH3╚▄ė┌╦«��Ż¼Ą╬╝ėĘė╠¬ūā╝tĄ─įŁę“);
(1)┼c╦ßēAųĖ╩Šä®ū„ė├
A.ūŽ╔½╩»╚’įćä®ė÷ĄĮēA╚▄ę║ūā╦{;
B.¤o╔½Ęė╠¬ė÷ĄĮēA╚▄ę║ūā╝t���ĪŻ
(2)ēA╚▄ę║ + ĘŪĮī┘č§╗»╬’ → ¹} + ╦«(ĘŪĮī┘č§╗»╬’ėųĘQ╦ßąįč§╗»╬’�����Ż¼įōĘ┤æ¬▓╗╩ŪÅ═ĘųĮŌĘ┤æ¬)
╚ńŻ║
2NaOH + CO2 = Na2CO3 + H2O;
Ca(OH)2 + SO2 = CaSO3↓ + H2O;
(3)ēA + ╦ß = ¹} + ╦«
(4)ēA + ¹} = ą┬¹} + ą┬ēA
╚ńŻ║
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓;
Ca(OH)2+Na2CO3=2NaOH+CaCO3↓(╣żśI(y©©)ųŲēAĘ©����Ż¼╝āēAųŲ¤²ēA);
3.Å═ĘųĮŌĘ┤æ¬Ż║ėąā╔ĘN╗»║Ž╬’ŽÓ╗źĮ╗ōQ│╔Ęų���Ż¼╔·│╔┴Ē═Ōā╔ĘN╗»║Ž╬’Ą─Ę┤æ¬�ĪŻ
Ę┤æ¬▒Ē▀_╩ĮŻ║AB + CD =AD + CB ▒Ē╩Š��ĪŻ
╠ž³cŻ║(ā╔ā╔Į╗ōQ���Ż¼āræB(t©żi)▓╗ūā)
(1)Ę┤æ¬╬’��Īó╔·│╔╬’Š∙ų╗ėąā╔ĘN╗»║Ž╬’;
(2)░l(f©Ī)╔·Ę┤æ¬Ą─ā╔ĘN╗»║Ž╬’ŽÓ╗źĮ╗ōQ│╔Ęų;
(3)Ė„į¬╦žĄ─╗»║Žārį┌Ę┤æ¬Ū░║¾Š∙▓╗Ė─ūā���ĪŻ
ūóŻ║ļy╚▄ąįēA╩▄¤ßęūĘųĮŌ(▓╗ī┘ė┌ēAĄ─═©ąį)
Ī÷ ÄūĘNųžę¬Ą─¹}
ę╗���Īó¹}
1.¹}Ą─ĘųŅÉŻ║ę└ō■(j©┤)ĮM│╔¹}Ą─Ļ¢ļxūė║═╦ßĖ∙Ą─ĘNŅÉ▀MąąĘųŅÉ
Ė∙ō■(j©┤)Ļ¢ļxūėĄ─▓╗═¼�����Ż¼¹}┐╔ęįĘų×ķŌc¹}��ĪóŌø¹}�����ĪóµV¹}�����ĪóĶF¹}���Īóõ@¹}Ą╚�ĪŻ(┬╚╗»Ōc×ķŌc¹})
Ė∙ō■(j©┤)╦ßĖ∙Ą─▓╗═¼�Ż¼¹}┐╔ęįĘų×ķ┴“╦ß¹}��Īó╠╝╦ß¹}����ĪóŽ§╦ß¹}��Īó¹}╦ß¹}Ą╚����ĪŻ(┬╚╗»Ōc×ķ¹}╦ß¹})
2.╦ßĪóēA����Īó¹}Ą─╚▄ĮŌąįęÄ(gu©®)┬╔Ż║
ó┘╦ßČ╝╚▄;ó┌╚▄ēAėą╬Õ╬╗Ż║ŌøĪóŌc���Īóõ@�ĪóŌ}���Īóõ^;ó█Ōø¹}��ĪóŌc¹}�Īóõ@¹}��ĪóŽ§╦ß¹}Č╝┐╔╚▄;ó▄¹}╦ß¹}ų╗ėą┬╚╗»Ńy▓╗┐╔╚▄;ó▌┴“╦ß¹}ų╗ėą┴“╦ßõ^▓╗┐╔╚▄;ó▐╠╝╦ß¹}ų╗╚▄ŌøĪóŌc����Īóõ@Ż¼╩ŻŽ┬Č╝▓╗╚▄����ĪŻ
ūóęŌŻ║AgCl���ĪóBaSO4▓╗āH▓╗╚▄ė┌╦«��Ż¼Č°Ūę▓╗╚▄ė┌ŽĪŽ§╦ß���ĪŻ
10ĘN│ŻęŖ│┴ĄĒŻ║
AgCl↓ĪóBaSO4↓Ż║▓╗║═╦ßĘ┤æ¬;
ęįŽ┬Ą─│┴ĄĒČ╝║═╦ßĘ┤æ¬Ż║
Cu(OH)2↓Ż║╦{╔½│┴ĄĒ;
F e(OH)3↓:╝t║ų╔½│┴ĄĒ;
ŲõėÓĄ─│┴ĄĒČ╝╩Ū░ū╔½Ż║
BaCO3↓�����ĪóCaCO3↓Ż║║═╦ßĘ┤æ¬���Ż¼«a(ch©Żn)╔·ÜŌ¾w����Ż¼ÜŌ¾w─▄╩╣│╬ŪÕ╩»╗ę╦«ūā£åØß;
Zn(OH)2↓ĪóMg(OH)2↓�����ĪóFe(OH)2↓��ĪóAl(OH)3;
3.¹}Ą─╗»īWąį┘|(zh©¼)Ż║
(1)¹} + Įī┘ =ą┬¹} + ą┬Įī┘(ų├ōQĘ┤æ¬)
į┌Įī┘╗ŅäėąįĒśą“▒Ēųą�����Ż¼│²ĘŪ│����Ż╗ŅØŖĄ─Įī┘KĪóCa�ĪóNaų«═ŌŻ¼┼┼į┌Ū░├µĄ─Įī┘ę╗░Ń┐╔ęįīó╬╗ė┌Ųõ║¾├µĄ─���Īó▒╚╦³▓╗╗ŅØŖĄ─Įī┘Å─╦³éāĄ─¹}╚▄ę║ųąų├ōQ│÷üĒ�����Ż¼╚ńŻ║
Zn + CuSO4 = ZnSO4 + Cu;
Cu + 2AgNO3 = 2Ag + Cu(NO3)2;
(2)¹}+ēA = ą┬¹}+ą┬ēA
╚ńŻ║
CuSO4 + Ca(OH)2 = Cu(OH)2↓ + CaSO4;(CuSO4 ║═ Ca(OH)2 ┼õų├▐r(n©«ng)╦Ä▓©Ā¢ČÓę║)
(3)¹}+╦ß = ą┬¹}+ą┬╦ß
Na2CO3+2HCl ==2NaCl+H2O+CO2↑
Ī÷┼ąöÓÅ═ĘųĮŌĘ┤æ¬░l(f©Ī)╔·Ą─Śl╝■Ż║
a.ėą│┴ĄĒ╔·│╔;
b.ėąÜŌ¾wĘ┼│÷;
c.ėą╦«╔·│╔;
d.╚ń╣¹╩Ūø]ėą╦ßģó╝ėĄ─Ę┤æ¬���Ż¼ätā╔ĘNĘ┤æ¬╬’▒žĒÜČ╝╚▄ė┌╦«�����ĪŻ
Č■���ĪóÄūĘN│ŻęŖĄ─¹}
1.┬╚╗»Ōc(NaCl)
ÅNĘ┐ųą│ŻęŖĄ─š{(di©żo)╬Čä®;╔·└Ē¹}╦«Ą─│╔Ęų;▐r(n©«ng)śI(y©©)╔Žė├üĒ▀xĘN;ū÷▒∙讎¹╚┌ä®ĪŻ
2.╠╝╦ßŌc(Na2CO3)
(1)╦ū├¹Ż║╝āēA���Īó╠K┤“
(2)╝āēA▓╗╩ŪēA��Ż¼╩Ū¹}(╦«╚▄ę║’@ēAąį)
(3)ė├═ŠŻ║▓Ż┴¦�����Īóįņ╝łĪó╝Å┐Ś║═Ž┤£ņ䮥─╔·«a(ch©Żn)Ą╚
(4)Na2CO3+ 2HCl =2NaCl + CO2↑+ H2O(£ń╗Ų„Ą─įŁ└Ē)
3.╠╝╦ßÜõŌc(NaHCO3)
(1)╦ū├¹Ż║ąĪ╠K┤“
(2)ė├═ŠŻ║▒║ųŲĖŌ³c;░l(f©Ī)Į═Ę█Ą─ų„ę¬│╔Ęų��Īóų╬»¤╬Ė╦ß▀^ČÓ;
(3)NaHCO3+ HCl =NaCl + CO2↑+ H2O .
4.╠╝╦ßŌ}(CaCO3)
(1)┤¾└Ē╩»���Īó╩»╗ę╩»���ĪóńŖ╚ķ╩»ĪóžÉÜż����Īóšõųķ�ĪóĄ░Üż����ĪóÕüĀt║═╦«ēžĄ─╦«╣ĖĄ─ų„ę¬│╔Ęų
(2)ė├═ŠŻ║Į©ų■▓─┴ŽĪóčaŌ}ä®
(3)CaCO3+2HCl===CaCl2+ CO2↑+ H2O;
(4)ŽÓī”Ęųūė┘|(zh©¼)┴┐×ķ100��Ż¼Caį¬╦žĄ─┘|(zh©¼)┴┐ĘųöĄ(sh©┤)š╝40%.
ča│õŻ║╠╝╦ß¹}(CO32-���ĪóHCO3-)Ą─Öz“ׯ║
A.Ž“┤²£y╚▄ę║ųą╝ė╚ļŽĪHCl║¾ėąÜŌ┼▌╔·│╔�Ż¼īó«a(ch©Żn)╔·Ą─ÜŌ¾w═©╚ļ│╬ŪÕ╩»╗ę╦«�����Ż¼╚¶│╬ŪÕ╩»╗ę
╦«ūā£åØß�����Ż¼ät╚▄ę║ųą║¼ėąCO32-;╚¶│╬ŪÕ╩»╗ę╦«¤oūā╗»����Ż¼ät╚▄ę║ųą▓╗║¼ėąCO32-ĪŻ
B.Ž“┤²£y╚▄ę║ųą╝ė╚ļBaCl2╚▄ę║║¾ėą░ū╔½│┴ĄĒ╔·│╔Ż¼Ą╬╚ļŽĪHCl║¾��Ż¼│┴ĄĒŽ¹╩¦ŪęėąÜŌ┼▌╔·
│╔���Ż¼ät╚▄ę║ųą║¼ėąCO32-���ĪŻ
╚²Īó╗»īWĘ╩┴Ž
▐r(n©«ng)ū„╬’Ą─╔·ķLąĶę¬N�ĪóPĪóKĄ╚ĀIB(y©Żng)į¬╦ž��ĪŻ║¼ėą▀@ą®į¬╦žĄ──│ą®╬’┘|(zh©¼)┐╔ęįū„×ķĘ╩┴Ž���ĪŻ═©▀^╗»īW╝ė╣ż╔·«a(ch©Żn)Ą─Ę╩┴Ž��Ż¼ĘQū„╗»īWĘ╩┴Ž��ĪŻ
1Īó│Żė├Ą─Ę╩┴ŽŻ║
╗»īWĘ╩┴ŽŻ║░▒ÜŌ(NH3·H2O)���Īó╠╝╦ßÜõõ@(NH4HCO3)��Īó┴“╦ßŌø(K2SO4)�Īó┴ūĄVĘ█[ų„ę¬│╔Ęų┴ū╦ßŌ}Ca3(PO4)2]Īó┴“╦ßõ@[(NH4)2SO4]����Īó─“╦ž[CO(NH2)2]ĪóŽ§╦ßŌø(KNO3)�����Īó┴ū╦ßČ■Üõõ@(NH4H2PO4)��ĪŻ
▐r(n©«ng)╝ęĘ╩┴ŽŻ║╚ńIJĘ╩���Īó╚╦╝S─“���ĪóŠGĘ╩Ą╚ĪŻ
2��ĪóĖ„ĘNĘ╩┴ŽĄ─╣”ą¦(Ōø┐╣Ą╣Ę³┴ū┐╣║Ą(║«)���Ż¼╚~Ų¼░l(f©Ī)³Sę¬ė├Ą¬)
Ą¬Ę╩ū„ė├Ż║┤┘▀Mų▓╬’Ūo���Īó╚~╔·ķL├»╩óĪó╚~╔½ØŌŠG(┤┘├ń); ╚▒Ą¬Ż║╚~³S
ŌøĘ╩ū„ė├Ż║┤┘╩╣ū„╬’╔·ķLĮĪēč����ĪóŪoŚU┤ųė▓���Ż¼┐╣Ą╣Ę³(ēčČÆ); ╚▒ŌøŻ║╚~╝Ō░l(f©Ī)³SŻ¼ęūĄ╣Ę³
┴ūĘ╩ū„ė├Ż║┤┘▀Mų▓╬’Ė∙ŽĄ░l(f©Ī)▀_��Ż¼╦ļ┴Żį÷ČÓ��Ż¼’¢ØM(┤▀╣¹); ╚▒┴ūŻ║╔·ķL▀tŠÅ���Ż¼«a(ch©Żn)┴┐ĮĄĄ═�����Ż¼Ė∙ŽĄ▓╗░l(f©Ī)▀_��ĪŻ
3���ĪóĄ¬Īó┴ū���ĪóŌø╚²ĘN╗»Ę╩Ą─ģ^(q©▒)äeĘĮĘ©

4Īóõ@æB(t©żi)Ą¬Ę╩┼cēA╗ņ║Ž╝ė¤ß�����Ż¼╗“š▀čą─źŻ¼Č╝ėą░▒ÜŌĘ┼│÷:(Ę┤æ¬īŹ┘|(zh©¼)Ż║NH4+ + OH- = NH3↑ + H2O)
(NH4)2SO4 + 2NaOH = Na2SO4 + 2NH3↑+ 2H2O;
2NH4NO3 + Ca(OH)2 = Ca(NO3)2 + 2NH3↑+2H2O;
░▒ÜŌėą┤╠╝żąįÜŌ╬Č��Ż¼─▄╩╣?ji©”)±ØÖĄ─╝t╔½╩»╚’įć╝łūā╦{��Ż¼▀@ą®┐╔ė├ė┌õ@æB(t©żi)Ą¬Ę╩Ą─Öz“×���ĪŻ
NH4+Ą─Öz“×:╝ėēAčą─ź���Ż¼┬äÜŌ╬ČĪŻ
įć䮯║ēA(NaOH���ĪóCa(OH)2Ą╚)�����ĪóرØÖĄ─╝t╔½╩»╚’įć╝ł
╦ßēA¹}Ą─╗∙ĄAų¬ūR║▄ČÓ��Ż¼║▄┴Ń╦ķ��Ż¼Ą½╩Ū┐╝įćĄ─Ņ}─┐ŠC║ŽąįŠ═▒╚▌^ÅŖ��Ż¼╦∙ęįų¬ūR³cĄ─┤«═©╩ŪĘŪ│Żėą▒žę¬Ą─����Ż¼ėąų·ė┌╝ė╔ŅīW┴ĢĪŻ
Ī’å╬┘|(zh©¼)�Īóč§╗»╬’Īó╦ß����ĪóēAĪó¹}Ą─ŽÓ╗źĻPŽĄ
(1)Įī┘å╬┘|(zh©¼)+╦ß=¹}+ÜõÜŌ(ų├ōQĘ┤æ¬)
1.õ\║═ŽĪ┴“╦߯║Zn+H 2SO4 = ZnSO4+H 2↑(īŹ“×╩ęųŲ╚ĪÜõÜŌ����Ż¼ūŅ│Żė├)
(īŹ“×╩ęųŲH2ė├Ą─Įī┘ėąZn,Fe,Mg,AlŻ¼╦ßėąŽĪH2SO4║═ŽĪHCl���Ż¼Č°Mg║═AlĘ┤æ¬╠½┐ņ��Ż¼╔·│╔Ą─ÜõÜŌ▓╗ęū╩š╝»��ĪŻ)
(2)Įī┘å╬┘|(zh©¼)+¹}(╚▄ę║)= ┴Ēę╗ĘNĮī┘+┴Ēę╗ĘN¹}
2.ĶF║═┴“╦ßŃ~╚▄ę║Ę┤æ¬Ż║Fe+CuSO4=FeSO4+Cu(╣┼┤·Ą─“Ø±Ę©ę▒Į”);
3.õX║═Ž§╦ßŃy╚▄ę║Ę┤æ¬Ż║Al+3AgNO3 = Al(NO3)3 + 3Ag;
(3)ēAąįč§╗»╬’(Įī┘č§╗»╬’)+╦ß = ¹}+╦«(ī┘ė┌Å═ĘųĮŌĘ┤æ¬)
4.č§╗»ĶF║═ŽĪ┴“╦ßĘ┤æ¬Ż║Fe2O3+3H2SO4=Fe2(SO4)3+3H2O(┴“╦ß│²ĶFõP)
5.č§╗»Ō}║═ŽĪ¹}╦ßĘ┤æ¬Ż║CaO+2HCl = CaCl2 +H2O ;
(4)╦ßąįč§╗»╬’(ĘŪĮī┘č§╗»╬’) + ēA = ¹}+╦«(▓╗╩ŪÅ═ĘųĮŌĘ┤æ¬)
6.┐┴ąįŌc▒®┬Čį┌┐šÜŌųąūā┘|(zh©¼)Ż║2NaOH+CO2 = Na2CO3 + H2O;
7.Ž¹╩»╗ęĘ┼į┌┐šÜŌųąūā┘|(zh©¼)Ż║Ca(OH)2 + CO2 = CaCO3↓+H2O;
(5)╦ß+ēA=¹}+╦«(ųą║═Ę┤æ¬) ╗∙▒ŠĘ┤æ¬ŅÉą═Ż║Å═ĘųĮŌĘ┤æ¬
8.¹}╦ß║═¤²ēAĘ┤æ¬Ż║HCl + NaOH = NaCl + H2O;
9.¹}╦ß║═Üõč§╗»Ō}Ę┤æ¬Ż║2HCl+Ca(OH)2=CaCl2+2H2O;
10.Üõč§Ōc║═┴“╦ßĘ┤æ¬Ż║2NaOH + H2SO4=Na2SO4+2H2O;
(6)╦ß+¹}=┴Ēę╗ĘN╦ß+┴Ēę╗ĘN¹}
11.┤¾└Ē╩»┼cŽĪ¹}╦ßĘ┤æ¬Ż║CaCO3+2HCl=CaCl2+H2O+CO2↑(īŹ“×╩ęųŲCO2);
12.╠╝╦ßŌc┼cŽĪ¹}╦ßĘ┤æ¬:Na2CO3 +2HCl=2NaCl+H2O+CO2↑;
13.┴“╦ß║═┬╚╗»õ^╚▄ę║Ę┤æ¬Ż║H2SO4+BaCl2=BaSO4↓+2HCl;
(7)ēA+¹}=┴Ēę╗ĘNēA+┴Ēę╗ĘN¹}
14.Üõč§╗»Ō}┼c╠╝╦ßŌcŻ║Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
15.┴“╦ßŃ~╚▄ę║┼cÜõč§╗»õ^Ż║CuSO4+Ba(OH)2=BaSO4↓+Cu(OH)2↓;
(8)¹}+¹} = ą┬¹} + ą┬¹}
16.┬╚╗»Ōc╚▄ę║║═Ž§╦ßŃy╚▄ę║Ż║NaCl + AgNO3 = AgCl↓ + NaNO3
17.┴“╦ßŌc║═┬╚╗»õ^Ż║Na2SO4+BaCl2 = BaSO4↓ + 2NaCl;
☞į┘┤╬ÅŖš{(di©żo)Ż║
Å═ĘųĮŌĘ┤æ¬▒žĒÜ╔·│╔│┴ĄĒ���Ż¼ÜŌ¾w╗“╦«╔·│╔▓┼─▄░l(f©Ī)╔·Ż¼Ūę╔·│╔╬’Ą─į¬╦ž╗»║Žār▓╗ūā���ĪŻ
īæį┌ūŅ║¾Ż║╦ßēA¹}ų¬ūR³c┴Ń╦ķ���Ż¼Ą½┐╝įćėų║▄ųžę¬Ż¼╔µ╝░ĄĮĄ──ŻēK╚ń╬’┘|(zh©¼)Ą─│²ļs�����Ż¼Ķbäe���Ż¼╠ß╝ā�����Ż¼ļxūė╣▓┤µ��Ż¼╬’┘|(zh©¼)│╔ĘųĄ─╠ĮŠ┐Ą╚Ą╚�Ż¼▀@ą®Č╝ąĶę¬░č╗∙▒ŠĄ─ų¬ūR³cėøæø��Ż¼ŠC║Žæ¬ė├����ĪŻ╗»īWĄ─īW┴Ģļx▓╗ķ_╗»īWĘĮ│╠╩Į�����Ż¼Ę┤æ¬Ą─¼F(xi©żn)Ž¾Ż¼╬’┘|(zh©¼)Ą─└Ē╗»ąį┘|(zh©¼)���Ż¼╬’┘|(zh©¼)Ą─╦ūĘQ�����Īóė├═ŠĄ╚Ą╚��Ż¼▀@ą®Č╝╩ŪąĶę¬ėøæøšŲ╬šĄ─���ĪŻĘ▓╩ŪČÓŽ┬╣”Ę“Ż¼ČÓ┐éĮY���Ż¼į┘╝ė╔ŽŅ}─┐Ą─ŠÜ┴Ģ�����Ż¼│§ųą╗»īW▀Ć╩Ū║▄║åå╬Ą─���ĪŻ
ĪĪĪĪ ÜgėŁ╩╣ė├╩ųÖCĪóŲĮ░ÕĄ╚ęŲäėįOéõįLå¢ųą┐╝ŠW(w©Żng)��Ż¼2023ųą┐╝ę╗┬Ę┼Ń░ķ═¼ąąŻĪ>>³cō¶▓ķ┐┤











