
一���、酸及酸的通性

酸的定義���,電離時(shí)生成的陽(yáng)離子全部都是H
+
。酸是由氫離子和酸根離子構(gòu)成�����。
1、濃鹽酸����、濃硫酸的物理性質(zhì)�、特性、用途
#FormatImgID_2#
2.酸的通性:鹽 酸 HCl 硫酸 H2SO4
酸使紫色石蕊試液變紅��,使無色酚酞試液不變色��。
金屬+酸→鹽+氫氣Zn+2HCl=ZnCl2+H2↑Zn+ H2SO4=ZnSO4+H2↑
堿性氧化物+酸→鹽+水Fe2O3+6HCl=2FeCl3+3H2OFe2O3+3H2SO4=Fe2(SO4)3+3H2O
堿+酸→鹽+水NaOH+HCl=NaCl+H2OCu(OH)2+H2SO4=CuSO4+2H2O
鹽+酸→另一種鹽+另一種酸AgNO3+HCl=AgCl↓+HNO3BaCl2+H2SO4=BaSO4↓+2HCl
注意:(1)在‘金屬+酸→鹽+氫氣’中�,酸通常指的是稀硫酸和稀鹽酸,不能是濃硫酸或硝酸�。因?yàn)闈饬蛩峄蛳跛岫加袕?qiáng)氧化性,與金屬反應(yīng)時(shí)不能生成氫氣而生成了水;指在金屬活動(dòng)順序表中排在‘氫’前面的活潑金屬排在‘氫’后不能置換酸中的氫�。
(2)通過金屬跟酸的反應(yīng)情況導(dǎo)出金屬活動(dòng)順序表:
K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au
金屬活動(dòng)性由強(qiáng)逐漸減弱金屬活動(dòng)性順序中,金屬位置越靠前���,活動(dòng)性越強(qiáng)���,反應(yīng)越劇烈,所需時(shí)間越短�。
(3)濃硫酸具有吸水性,通常用它作為干燥劑�。硫酸還具有脫水性,它對(duì)皮膚或衣服有很強(qiáng)的腐蝕性。稀釋濃硫酸時(shí)一定要把濃硫酸沿著器壁慢慢地注入水里��,并不斷攪動(dòng)��,切不可把水倒進(jìn)濃硫酸里�����,如果把水注入濃硫酸里�����,水的密度較小���,會(huì)浮在硫酸上面���,溶解時(shí)放出的熱會(huì)使水立刻沸騰,使硫酸液向四處飛濺���,容易發(fā)生事故�。

二�、堿及堿的通性

定義:電離時(shí)生成的陰離子全部是OH
-
離子。堿是由金屬離子(或銨根離子)和氫氧根離子構(gòu)成��。
1、氫氧化鈉���、氫氧化鈣的物理性質(zhì)�����、用途
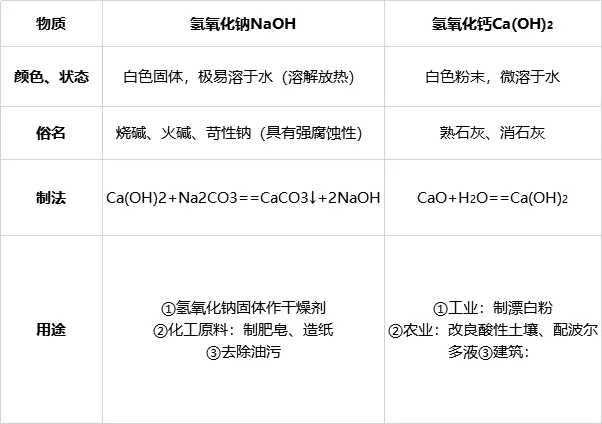
2.堿的通性
堿使紫色石蕊試液變藍(lán),使無色酚酞試液變紅�。氫氧化鈉使紫色石蕊試液變藍(lán),無色酚酞試液變紅���。氫氧化鈣使紫色石蕊試液變藍(lán)��,無色酚酞試液變紅����。
酸性氧化物+堿→鹽+水2NaOH+CO2=Na2CO3+H2OCa(OH)2+CO2=CaCO3↓+H2O
酸+堿→鹽+水NaOH+HCl=NaCl+H2OCa(OH)2+H2SO4=CaSO4+2H2O
鹽+堿→另一種鹽+另一種堿2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
注意:(1)只有可溶性堿才能跟一些非金屬氧化物發(fā)生反應(yīng)�,這些非金屬氧化物是酸性氧化物。酸性氧化物多數(shù)能溶于水�����,跟水化合生成酸��。
(2)鹽和堿反應(yīng)時(shí),必須兩者都是可溶的��,且生成物之一是沉淀�����,反應(yīng)才能進(jìn)行��。
(3)書寫堿跟某些金屬氧化物反應(yīng)的化學(xué)方程式
關(guān)于這類反應(yīng)化學(xué)方程式的書寫有人感到很困難���,為此��,可先寫出非金屬氧化物跟水反應(yīng)�,生成含氧酸的化學(xué)方程式��,再以含氧酸和堿相互交換成分寫出生成物�。兩式合并成一個(gè)化學(xué)方程式。如�,三氧化硫跟氫氧化鈉反應(yīng):

三、常見的鹽及鹽的性質(zhì)

1��、常見的鹽 定義:能解離出金屬離子(或NH4
+
)和酸根離子的化合物���。
注:此時(shí)的鹽不是指食鹽��,食鹽的主要成分是NaCl��。
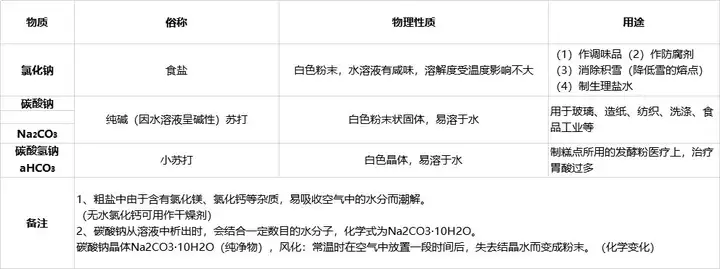
2���、精鹽提純——去除不溶性雜質(zhì)�����,得到的精鹽中還含有氯化鎂��、氯化鈣等可溶性雜質(zhì)。
(1)��、實(shí)驗(yàn)步驟:溶解����、過濾、蒸發(fā)
(2)����、實(shí)驗(yàn)儀器
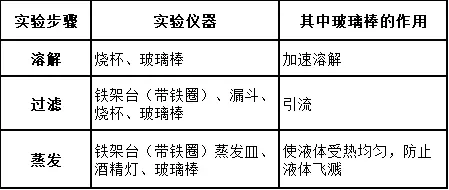
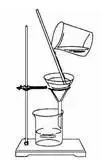
過濾 蒸發(fā)
注意:
①蒸發(fā)皿是可以直接加熱的儀器,液體體積不能超過蒸發(fā)皿2/3.
② 溶解時(shí)用玻璃棒攪拌�����,目的是加快溶解。
③ 加熱時(shí)用玻璃棒攪拌�,防止局部溫度過高造成液滴飛濺
④ 待蒸發(fā)皿中出現(xiàn)較多固體時(shí)停止加熱,利用余熱使濾液蒸干����,不能將濾液完全蒸干才停對(duì)于止加熱。
3.鹽的化學(xué)性質(zhì):
鹽溶液+金屬→鹽ˊ+金屬ˊCuSO4+Zn=ZnSO4+Cu
鹽+酸→鹽ˊ+酸ˊBaCl2+H2SO4=BaSO4↓+2HCl
鹽溶液+堿溶液→鹽ˊ+堿ˊ3NaOH+FeCl3=3NaCl+Fe(OH)3↓
鹽溶液+鹽溶液→鹽ˊ+鹽ˊAgNO3+NaCl=AgCl↓+NaNO3
注意:
在金屬活動(dòng)順序表中�,只有排在前面的金屬才能把排在后面的金屬?gòu)乃鼈兊柠}溶液中置換出來。但K��、Ca�、Na三種金屬與鹽溶液的反應(yīng)特殊,這里不要求���。

四����、明確復(fù)分解反應(yīng)
發(fā)生的本質(zhì)

1.復(fù)分解反應(yīng)及其發(fā)生的條件
復(fù)分解反應(yīng)的定義是:由兩種化合物相互交換成分�����,生成另外兩種化合物的反應(yīng)���。
通式:AB+CD=AD+CB
發(fā)生的條件:兩種物質(zhì)在溶液中相互交換離子��,生成物中如果有沉淀析出��、氣體放出或有水生成��,復(fù)分解反應(yīng)均可以發(fā)生���。
2.堿與酸性氧化物反應(yīng)不屬于復(fù)分解反應(yīng)

五���、熟記酸、堿��、鹽的溶解性

酸��、堿�����、鹽的溶解性記憶口訣:堿中氨����、鉀�、鈉、鋇�����、鈣可溶
鉀鈉銨鹽硝酸鹽,全部都屬可溶鹽��。
硫酸鹽不溶鋇和鉛;氯化物不溶銀亞汞��,碳酸鹽除鉀鈉銨溶�����,其它不溶��。

六�、幾個(gè)常見離子的檢驗(yàn)

1.Cl
-
離子的檢驗(yàn)
實(shí)驗(yàn)操作實(shí)驗(yàn)現(xiàn)象 實(shí)驗(yàn)結(jié)論化學(xué)方程式
取少量樣品于試管中,滴加AgNO3溶液和稀HNO3有不溶于稀硝酸的白色沉淀生成樣品含有Cl
-
AgNO3+KCl=AgCl↓+KNO3
2.SO4
2-
離子的檢驗(yàn):
取少量樣品于試管中��,滴加Ba(NO3)2溶液和稀HNO3有不溶于稀硝酸的白色沉淀生成樣品含有SO4
2-
Ba(NO3)2+H2SO4=BaSO4↓+2HNO3
3. CO3
2-
離子的檢驗(yàn):
取少量樣品于試管中����,滴加稀HCl,將生成的氣體通入澄清石灰水有無色氣體生成,該氣體使澄清石灰水變渾濁樣品含有CO3
2-
K2CO3+2HCl=2KCl+CO2↑+H2O CO2+Ca(OH)2=CaCO3↓+H2O
4��、檢驗(yàn)NH4
+
:
取少量待檢物于潔凈的試管中���,滴入適量NaOH溶液并加熱�,有使?jié)竦募t色石蕊試紙變成藍(lán)色的氣體產(chǎn)生。
5�、鑒別稀鹽酸和稀硫酸
——分別取少量待檢液體于兩支潔凈的試管中,各滴入幾滴BaCl2溶液���,有白色沉淀產(chǎn)生的原溶液是稀硫酸����,無現(xiàn)象產(chǎn)生的原溶液是稀鹽酸��。

七���、熟記常見元素����、
原子團(tuán)的化合價(jià)口訣:

(正價(jià))一氫鉀鈉銀�����,二鈣鎂鋇鋅�,三鋁��、四硅、五氮磷�。
(負(fù)價(jià))負(fù)一價(jià):氟、氯�、溴、碘;負(fù)二價(jià):氧和硫�����。(可變正價(jià)):一二銅汞��,二三鐵���,二四碳�,四六硫��。
(原子團(tuán)的化合價(jià))
負(fù)一價(jià):氫氧根(OH)�,硝酸根(NO3),氯酸根(ClO3)�,高錳酸根(MnO4);
負(fù)二價(jià):硫酸根(SO4),碳酸根(CO3)��,亞硫酸根(SO3)��,錳酸根(MnO4);
負(fù)三價(jià):磷酸根(PO4);正一價(jià):銨根(NH4)�����。

八、熟記常見物質(zhì)的俗稱�、
主要成分和化學(xué)式

生石灰——CaO 熟石灰——Ca(OH)2石灰石、大理石——CaCO3食鹽——NaCl火堿����、燒堿、苛性鈉——NaOH純堿��、蘇打——Na2CO3小蘇打——NaHCO3鐵銹�、赤鐵礦——Fe2O3赤鐵礦——Fe3O4 金剛石、石墨——C 干冰——CO2冰——H2O
天然氣(甲烷)——CH4酒精(乙醇)——C2H5OH醋酸(乙酸)——CH3COOH

九��、常見物質(zhì)的顏色

紅色的固體——Cu��、Fe2O3��、P(紅磷)
黑色的固體——C�、CuO、Fe3O4��、FeO���、MnO2
白色的固體——KClO3、P2O5、P(白磷)�、CuSO4(無水硫酸銅)、KCl��、NaCl等
暗紫色的固體——KMnO4黃色的固體——S
藍(lán)色的固體——CuSO4•5H2O藍(lán)色沉淀——Cu(OH)2
紅褐色沉淀——Fe(OH)3常見不溶于酸的白色沉淀——BaSO4��、AgCl
溶于酸并放出使澄清石灰水變渾濁的氣體的白色沉淀——BaCO3����、CaCO3溶于酸但不產(chǎn)生氣體的白色沉淀——Mg(OH)2、Al(OH)3等不溶性堿的沉淀
藍(lán)色的溶液——CuSO4��、CuCl2��、Cu(NO3)2等含Cu
2+
溶液
淺綠色的溶液——FeSO4�、FeCl2等含F(xiàn)e
2+
溶液
黃色的溶液——FeCl3、Fe2(SO4)3�、Fe(NO3)3等含F(xiàn)e
3+
溶液

補(bǔ)充下列反應(yīng)方程式:

1、氫氧化銅跟稀鹽酸反應(yīng):Cu(OH)2+ 2HCl = CuCl2+ 2H2O藍(lán)色沉淀消失
2���、氫氧化銅跟稀硫酸反應(yīng):Cu(OH)2+ H2SO4= CuSO4+ 2H2O變成藍(lán)色溶液
3����、氫氧化鈉跟硫酸銅溶液反應(yīng):2NaOH+ CuSO4= Na2SO4+ Cu(OH)2↓ 有藍(lán)色沉淀產(chǎn)生
4�、氫氧化鈉跟氯化鐵溶液反應(yīng):3NaOH+ FeCl3 =Fe(OH)3↓+3NaCl 有紅褐色沉淀產(chǎn)生
判斷溶液的酸堿性——用指示劑����,溶液的酸堿度——用pH來表示����。

干燥劑的選擇

1、濃硫酸可干燥:酸性氣體(如:CO2���、SO2�����、SO3�、NO2�、HCl、)中性氣體(如:H2�、O2、N2�、CO) ※不能干燥堿性氣體(如:NH3)
2、氫氧化鈉固體��、生石灰��、堿石灰可干燥:堿性氣體(如:NH3)
中性氣體(如:H2�����、O2、N2�、CO)※不能干燥酸性氣體(如:CO2�����、SO2�、SO3、NO2�����、HCl�、)
3、無水硫酸銅固體遇水由白色變藍(lán)色����,可檢驗(yàn)水的存在,并吸收水蒸氣�。
歡迎使用手機(jī)、平板等移動(dòng)設(shè)備訪問中考網(wǎng)����,2024中考一路陪伴同行�����!>>點(diǎn)擊查看












