╗»║ŽĘ┤æ¬(y©®ng)
1�����ĪóµVį┌┐šÜŌųą╚╝¤²Ż║2Mg+O2

2MgO
2�ĪóĶFį┌č§ÜŌųą╚╝¤²Ż║3Fe+2O2

Fe3O4
3ĪóõXį┌┐šÜŌųą╚╝¤²Ż║4Al+3O2

2Al2O3
4�ĪóÜõÜŌį┌┐šÜŌųą╚╝¤²Ż║2H2+O2

2H2O
5Īó╝t┴ūį┌┐šÜŌųą╚╝¤²Ż║4P+5O2

2P2O5
6�Īó┴“Ę█į┌┐šÜŌųą╚╝¤²Ż║S+O2

SO2
7Īó╠╝į┌č§ÜŌųą│õĘų╚╝¤²Ż║C+O2

CO2
8�����Īó╠╝į┌č§ÜŌųą▓╗│õĘų╚╝¤²Ż║2C+O2

2CO
9ĪóČ■č§╗»╠╝═©▀^ūŲ¤ß╠╝īėŻ║C+CO2

2CO
10����Īóę╗č§╗»╠╝į┌č§ÜŌųą╚╝¤²Ż║2CO+O2

2CO2
11ĪóČ■č§╗»╠╝║═╦«Ę┤æ¬(y©®ng)(Č■č§╗»╠╝═©╚ļūŽ╔½╩»╚’įćę║)Ż║CO2+H2O==H2CO3
12�Īó╔·╩»╗ę╚▄ė┌╦«Ż║CaO+H2O==Ca(OH)2
13Īó¤o╦«┴“╦ßŃ~ū„Ė╔į’䮯║CuSO4+5H2O==CuSO4·5H2O
14�����ĪóŌcį┌┬╚ÜŌųą╚╝¤²Ż║2Na+Cl2

2NaCl
ĘųĮŌĘ┤æ¬(y©®ng)
15�����ĪóīŹ(sh©¬)“×(y©żn)╩ęė├ļpč§╦«ųŲč§ÜŌŻ║2H2O2
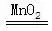
2H2O+O2↑
16����Īó╝ė¤ßĖ▀Õi╦ßŌøŻ║2KMnO4

K2MnO4+MnO2+O2↑
17Īó╦«į┌ų▒┴„ļŖĄ─ū„ė├Ž┬ĘųĮŌŻ║2H2O
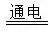
2H2↑+O2↑
18����Īó╠╝╦ß▓╗ĘĆ(w©¦n)Č©Č°ĘųĮŌŻ║H2CO3==H2O+CO2↑
19ĪóĖ▀£žņč¤²╩»╗ę╩»(Č■č§╗»╠╝╣żśI(y©©)ųŲĘ©)Ż║CaCO3 CaO+CO2↑
ų├ōQĘ┤æ¬(y©®ng)
20�ĪóĶF║═┴“╦ßŃ~╚▄ę║Ę┤æ¬(y©®ng)Ż║Fe+CuSO4==FeSO4+Cu
21Īóõ\║═ŽĪ┴“╦ßĘ┤æ¬(y©®ng)(īŹ(sh©¬)“×(y©żn)╩ęųŲÜõÜŌ)Ż║Zn+H2SO4==ZnSO4+H2↑
22ĪóµV║═ŽĪ¹}╦ßĘ┤æ¬(y©®ng)Ż║Mg+2HCl==MgCl2+H2↑
23�ĪóÜõÜŌ▀ĆįŁč§╗»Ń~Ż║H2+CuO Cu+H2O
24Īó─Š╠┐▀ĆįŁč§╗»Ń~Ż║C+2CuO 2Cu+CO2↑
25����Īó╦«š¶ÜŌ═©▀^ūŲ¤ß╠╝īėŻ║H2O+C H2+CO
26�ĪóĮ╣╠┐▀ĆįŁč§╗»ĶFŻ║3C+2Fe2O3 4Fe+3CO2↑
Ųõ╦¹
27.Üõč§╗»Ōc╚▄ę║┼c┴“╦ßŃ~╚▄ę║Ę┤æ¬(y©®ng)Ż║2NaOH+CuSO4==Cu(OH)2↓+Na2SO4
28Īó╝ū═ķį┌┐šÜŌųą╚╝¤²Ż║CH4+2O2 CO2+2H2O
29�����ĪóŠŲŠ½į┌┐šÜŌųą╚╝¤²Ż║C2H5OH+3O2 2CO2+3H2O
30�����Īóę╗č§╗»╠╝▀ĆįŁč§╗»Ń~Ż║CO+CuO

Cu+CO2
31����Īóę╗č§╗»╠╝▀ĆįŁč§╗»ĶFŻ║3CO+Fe2O3

2Fe+3CO2
32ĪóČ■č§╗»╠╝═©▀^│╬ŪÕ╩»╗ę╦«(Öz“×(y©żn)Č■č§╗»╠╝)Ż║Ca(OH)2+CO2==CaCO3↓+H2O
33�ĪóÜõč§╗»Ōc║═Č■č§╗»╠╝Ę┤æ¬(y©®ng)(│²╚źČ■č§╗»╠╝)Ż║2NaOH+CO2==Na2CO3+H2O
34Īó╩»╗ę╩»(╗“┤¾└Ē╩»)┼cŽĪ¹}╦ßĘ┤æ¬(y©®ng)(Č■č§╗»╠╝Ą─īŹ(sh©¬)“×(y©żn)╩ęųŲĘ©)Ż║CaCO3+2HCl==CaCl2+H2O+CO2↑
35�����Īó╠╝╦ßŌc┼cØŌ¹}╦ßĘ┤æ¬(y©®ng)(┼▌─Ł£ń╗Ų„Ą─įŁ└Ē): Na2CO3+2HCl==2NaCl+H2O+CO2↑
ę╗Ż« ╬’┘|(zh©¼)┼cč§ÜŌĄ─Ę┤æ¬(y©®ng)Ż║
ó┼å╬┘|(zh©¼)┼cč§ÜŌĄ─Ę┤æ¬(y©®ng)Ż║
1. µVį┌┐šÜŌųą╚╝¤²Ż║2Mg+O2

2MgO
2. ĶFį┌č§ÜŌųą╚╝¤²Ż║3Fe+2O2

Fe3O4
3. Ń~į┌┐šÜŌųą╩▄¤ßŻ║2Cu+O2

2CuO
4. õXį┌┐šÜŌųą╚╝¤²Ż║4Al+3O2

2Al2O3
5. ÜõÜŌųą┐šÜŌųą╚╝¤²Ż║2H2+O2

2H2O
6. ╝t┴ūį┌┐šÜŌųą╚╝¤²Ż║4P+5O2

2P2O5
7. ┴“Ę█į┌┐šÜŌųą╚╝¤²Ż║S+O2

SO2
8. ╠╝į┌č§ÜŌųą│õĘų╚╝¤²Ż║C+O2

CO2
9. ╠╝į┌č§ÜŌųą▓╗│õĘų╚╝¤²Ż║2C+O2

2CO
óŲ╗»║Ž╬’┼cč§ÜŌĄ─Ę┤æ¬(y©®ng)Ż║
10. ę╗č§╗»╠╝į┌č§ÜŌųą╚╝¤²Ż║2CO+O2

2CO2
11. ╝ū═ķį┌┐šÜŌųą╚╝¤²Ż║CH4+2O2

CO2+2H2O
12. ŠŲŠ½į┌┐šÜŌųą╚╝¤²Ż║C2H5OH+3O2

2CO2+3H2O
Č■Ż«ÄūéĆ(g©©)ĘųĮŌĘ┤æ¬(y©®ng)Ż║
13. ╦«į┌ų▒┴„ļŖĄ─ū„ė├Ž┬ĘųĮŌŻ║2H2O
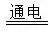
2H2↑+O2↑
14. ╝ė¤ßēA╩Į╠╝╦ßŃ~Ż║Cu2(OH)2CO3

2CuO+H2O+CO2↑
15. ╝ė¤ß┬╚╦ßŌø(ėą╔┘┴┐Ą─Č■č§╗»Õi)Ż║2KClO3
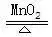
2KCl+3O2↑
16. ╝ė¤ßĖ▀Õi╦ßŌøŻ║2KMnO4

K2MnO4+MnO2+O2↑
17. ╠╝╦ß▓╗ĘĆ(w©¦n)Č©Č°ĘųĮŌŻ║H2CO3==H2O+CO2↑
18. Ė▀£žņč¤²╩»╗ę╩»Ż║CaCO3

CaO+CO2↑
╚²Ż«ÄūéĆ(g©©)č§╗»▀ĆįŁĘ┤æ¬(y©®ng)Ż║
19. ÜõÜŌ▀ĆįŁč§╗»Ń~Ż║H2+CuO

Cu+H2O
20. ─Š╠┐▀ĆįŁč§╗»Ń~Ż║C+2CuO

2Cu+CO2↑
21. Į╣╠┐▀ĆįŁč§╗»ĶFŻ║3C+2Fe2O3

4Fe+3CO2↑
22. Į╣╠┐▀ĆįŁ╦─č§╗»╚²ĶFŻ║2C+Fe3O4 3Fe+2CO2↑
23. ę╗č§╗»╠╝▀ĆįŁč§╗»Ń~Ż║CO+CuO Cu+CO2
24. ę╗č§╗»╠╝▀ĆįŁč§╗»ĶFŻ║3CO+Fe2O3 2Fe+3CO2
25. ę╗č§╗»╠╝▀ĆįŁ╦─č§╗»╚²ĶFŻ║4CO+Fe3O4 3Fe+4CO2
╦─Ż«å╬┘|(zh©¼)Īóč§╗»╬’�Īó╦ßĪóēA�Īó¹}Ą─ŽÓ╗źĻP(gu©Īn)ŽĄ
ó┼Įī┘å╬┘|(zh©¼) + ╦ß -------- ¹} + ÜõÜŌ Ż©ų├ōQĘ┤æ¬(y©®ng)Ż®
26. õ\║═ŽĪ┴“╦ßZn+H2SO4==ZnSO4+H2↑
27. ĶF║═ŽĪ┴“╦ßFe+H2SO4==FeSO4+H2↑
28. µV║═ŽĪ┴“╦ßMg+H2SO4==MgSO4+H2↑
29. õX║═ŽĪ┴“╦ß2Al+3H2SO4==Al2(SO4)3+3H2↑
30. õ\║═ŽĪ¹}╦ßZn+2HCl==ZnCl2+H2↑
31. ĶF║═ŽĪ¹}╦ßFe+2HCl==FeCl2+H2↑
32. µV║═ŽĪ¹}╦ßMg+2HCl==MgCl2+H2↑
33. õX║═ŽĪ¹}╦ß2Al+6HCl==2AlCl3+3H2↑
óŲĮī┘å╬┘|(zh©¼) + ¹}Ż©╚▄ę║Ż® ------- ┴Ēę╗ĘNĮī┘ + ┴Ēę╗ĘN¹}
34. ĶF║═┴“╦ßŃ~╚▄ę║Ę┤æ¬(y©®ng)Ż║Fe+CuSO4==FeSO4+Cu
35. õ\║═┴“╦ßŃ~╚▄ę║Ę┤æ¬(y©®ng)Ż║Zn+CuSO4==ZnSO4+Cu
36. Ń~║═Ž§╦ß╣»╚▄ę║Ę┤æ¬(y©®ng)Ż║Cu+Hg(NO3)2==Cu(NO3)2+Hg
óŪēAąįč§╗»╬’ +╦ß -------- ¹} + ╦«
37. č§╗»ĶF║═ŽĪ¹}╦ßĘ┤æ¬(y©®ng)Ż║Fe2O3+6HCl==2FeCl3+3H2O
38. č§╗»ĶF║═ŽĪ┴“╦ßĘ┤æ¬(y©®ng)Ż║Fe2O3+3H2SO4==Fe2(SO4)3+3H2O
39. č§╗»Ń~║═ŽĪ¹}╦ßĘ┤æ¬(y©®ng)Ż║CuO+2HCl==CuCl2+H2O
40. č§╗»Ń~║═ŽĪ┴“╦ßĘ┤æ¬(y©®ng)Ż║CuO+H2SO4==CuSO4+H2O
41. č§╗»µV║═ŽĪ┴“╦ßĘ┤æ¬(y©®ng)Ż║MgO+H2SO4==MgSO4+H2O
42. č§╗»Ō}║═ŽĪ¹}╦ßĘ┤æ¬(y©®ng)Ż║CaO+2HCl==CaCl2+H2O
ó╚╦ßąįč§╗»╬’ +ēA -------- ¹} + ╦«
43.┐┴ąįŌc▒®┬Čį┌┐šÜŌųąūā┘|(zh©¼)Ż║2NaOH+CO2==Na2CO3+H2O
44.┐┴ąįŌc╬³╩šČ■č§╗»┴“ÜŌ¾wŻ║2NaOH+SO2==Na2SO3+H2O
45.┐┴ąįŌc╬³╩š╚²č§╗»┴“ÜŌ¾wŻ║2NaOH+SO3==Na2SO4+H2O
46.Ž¹╩»╗ęĘ┼į┌┐šÜŌųąūā┘|(zh©¼)Ż║Ca(OH)2+CO2==CaCO3↓+H2O
47. Ž¹╩»╗ę╬³╩šČ■č§╗»┴“Ż║Ca(OH)2+SO2==CaSO3↓+H2O
ó╔╦ß + ēA -------- ¹} + ╦«
48.¹}╦ß║═¤²ēAŲĘ┤æ¬(y©®ng)Ż║HCl+NaOH==NaCl+H2O
49. ¹}╦ß║═Üõč§╗»ŌøĘ┤æ¬(y©®ng)Ż║HCl+KOH==KCl+H2O
50.¹}╦ß║═Üõč§╗»Ń~Ę┤æ¬(y©®ng)Ż║2HCl+Cu(OH)2==CuCl2+2H2O
51. ¹}╦ß║═Üõč§╗»Ō}Ę┤æ¬(y©®ng)Ż║2HCl+Ca(OH)2==CaCl2+2H2O
52. ¹}╦ß║═Üõč§╗»ĶFĘ┤æ¬(y©®ng)Ż║3HCl+Fe(OH)3==FeCl3+3H2O
53.Üõč§╗»õX╦Ä╬’ų╬»¤╬Ė╦ß▀^ČÓŻ║3HCl+Al(OH)3==AlCl3+3H2O
54.┴“╦ß║═¤²ēAĘ┤æ¬(y©®ng)Ż║H2SO4+2NaOH==Na2SO4+2H2O
55.┴“╦ß║═Üõč§╗»ŌøĘ┤æ¬(y©®ng)Ż║H2SO4+2KOH==K2SO4+2H2O
56.┴“╦ß║═Üõč§╗»Ń~Ę┤æ¬(y©®ng)Ż║H2SO4+Cu(OH)2==CuSO4+2H2O
57.┴“╦ß║═Üõč§╗»ĶFĘ┤æ¬(y©®ng)Ż║3H2SO4+2Fe(OH)3==Fe2(SO4)3+ 6H2O
58.Ž§╦ß║═¤²ēAĘ┤æ¬(y©®ng)Ż║HNO3+NaOH==NaNO3+H2O
ó╩╦ß + ¹} -------- ┴Ēę╗ĘN╦ß + ┴Ēę╗ĘN¹}
59.┤¾└Ē╩»┼cŽĪ¹}╦ßĘ┤æ¬(y©®ng)Ż║CaCO3+2HCl==CaCl2+H2O+CO2↑
60.╠╝╦ßŌc┼cŽĪ¹}╦ßĘ┤æ¬(y©®ng): Na2CO3+2HCl==2NaCl+H2O+CO2↑
61.╠╝╦ßµV┼cŽĪ¹}╦ßĘ┤æ¬(y©®ng): MgCO3+2HCl==MgCl2+H2O+CO2↑
62.¹}╦ß║═Ž§╦ßŃy╚▄ę║Ę┤æ¬(y©®ng)Ż║HCl+AgNO3==AgCl↓+HNO3
63.┴“╦ß║═╠╝╦ßŌcĘ┤æ¬(y©®ng)Ż║Na2CO3+H2SO4==Na2SO4+H2O+CO2↑
64.┴“╦ß║═┬╚╗»õ^╚▄ę║Ę┤æ¬(y©®ng)Ż║H2SO4+BaCl2==BaSO4↓+2HCl
ó╦ēA + ¹} -------- ┴Ēę╗ĘNēA + ┴Ēę╗ĘN¹}
65.Üõč§╗»Ōc┼c┴“╦ßŃ~Ż║2NaOH+CuSO4==Cu(OH)2↓+Na2SO4
66.Üõč§╗»Ōc┼c┬╚╗»ĶFŻ║3NaOH+FeCl3==Fe(OH)3↓+3NaCl
67.Üõč§╗»Ōc┼c┬╚╗»µVŻ║2NaOH+MgCl2==Mg(OH)2↓+2NaCl
68. Üõč§╗»Ōc┼c┬╚╗»Ń~Ż║2NaOH+CuCl2==Cu(OH)2↓+2NaCl
69. Üõč§╗»Ō}┼c╠╝╦ßŌcŻ║Ca(OH)2+Na2CO3==CaCO3↓+2NaOH
ó╠¹} + ¹} ----- ā╔ĘNą┬¹}
70.┬╚╗»Ōc╚▄ę║║═Ž§╦ßŃy╚▄ę║Ż║NaCl+AgNO3==AgCl↓+NaNO3
71.┴“╦ßŌc║═┬╚╗»õ^Ż║Na2SO4+BaCl2==BaSO4↓+2NaCl
╬ÕŻ«Ųõ╦³Ę┤æ¬(y©®ng)Ż║
72.Č■č§╗»╠╝╚▄ĮŌė┌╦«Ż║CO2+H2O==H2CO3
73.╔·╩»╗ę╚▄ė┌╦«Ż║CaO+H2O==Ca(OH)2
74.č§╗»Ōc╚▄ė┌╦«Ż║Na2O+H2O==2NaOH
75.╚²č§╗»┴“╚▄ė┌╦«Ż║SO3+H2O==H2SO4
76.┴“╦ßŃ~Š¦¾w╩▄¤ßĘųĮŌŻ║CuSO4·5H2O

CuSO4+5H2O
77.¤o╦«┴“╦ßŃ~ū„Ė╔į’䮯║CuSO4+5H2O==CuSO4·5H2O
╗»īW(xu©”)ĘĮ│╠╩Į Ę┤æ¬(y©®ng)¼F(xi©żn)Ž¾ æ¬(y©®ng)ė├
2Mg+O2

2MgOäĪ┴ę╚╝¤².ę½č█░ū╣Ō.╔·│╔░ū╔½╣╠¾w.Ę┼¤ß.«a(ch©Żn)╔·┤¾┴┐░ū¤¤ ░ū╔½ą┼╠¢(h©żo)ÅŚ
2Hg+O2

2HgOŃy░ūę║¾wĪó╔·│╔╝t╔½╣╠¾w └Ł═▀ÕaīŹ(sh©¬)“×(y©żn)
2Cu+O2

2CuO╝t╔½Įī┘ūā?y©Łu)ķ║┌╔½╣╠¾w
4Al+3O2

2Al2O3Ńy░ūĮī┘ūā?y©Łu)ķ░ū╔½╣╠¾w
3Fe+2O2 Fe3O4äĪ┴ę╚╝¤²����Īó╗ąŪ╦─╔õĪó╔·│╔║┌╔½╣╠¾w�����ĪóĘ┼¤ß
C+O2 CO2äĪ┴ę╚╝¤²�Īó░ū╣ŌĪóĘ┼¤ß����Īó╩╣╩»╗ę╦«ūā£åØß
S+O2SO2äĪ┴ę╚╝¤²ĪóĘ┼¤ß����Īó┤╠╝ż╬ČÜŌ¾wĪó┐šÜŌųąĄŁ╦{(l©ón)╔½╗čµ.č§ÜŌųą╦{(l©ón)ūŽ╔½╗čµ
2H2+O2 2H2OĄŁ╦{(l©ón)╗čµ�����ĪóĘ┼¤ßĪó╔·│╔╩╣¤o╦«CuSO4ūā╦{(l©ón)Ą─ę║¾w(╦«) Ė▀─▄╚╝┴Ž
4P+5O2 2P2O5 äĪ┴ę╚╝¤²�����Īó┤¾┴┐░ū¤¤�ĪóĘ┼¤ßĪó╔·│╔░ū╔½╣╠¾w ūC├„┐šÜŌųąč§ÜŌ║¼┴┐
CH4+2O2 2H2O+CO2 ╦{(l©ón)╔½╗čµ�����ĪóĘ┼¤ß�Īó╔·│╔╩╣╩»╗ę╦«ūā£åØßÜŌ¾w║═╩╣¤o╦«CuSO4ūā╦{(l©ón)Ą─ę║¾w(╦«) ╝ū═ķ║═╠ņ╚╗ÜŌĄ─╚╝¤²
2C2H2+5O2 2H2O+4CO2 ╦{(l©ón)╔½╗čµ�ĪóĘ┼¤ßĪó║┌¤¤����Īó╔·│╔╩╣╩»╗ę╦«ūā£åØßÜŌ¾w║═╩╣¤o╦«CuSO4ūā╦{(l©ón)Ą─ę║¾w(╦«) č§╚▓čµĪó║ĖĮėŪąĖŅĮī┘
2KClO3 2KCl+3O2↑ ╔·│╔╩╣Ħ╗ąŪĄ──ŠŚlÅ═(f©┤)╚╝Ą─ÜŌ¾w īŹ(sh©¬)“×(y©żn)╩ęųŲéõč§ÜŌ
2KMnO4 K2MnO4+MnO2+O2↑ ūŽ╔½ūā?y©Łu)ķ║┌╔½�Īó╔·│╔╩╣Ħ╗ąŪ─ŠŚlÅ═(f©┤)╚╝Ą─ÜŌ¾w īŹ(sh©¬)“×(y©żn)╩ęųŲéõč§ÜŌ
2HgO 2Hg+O2↑ ╝t╔½ūā?y©Łu)ķŃy░ūĪó╔·│╔╩╣Ħ╗ąŪ─ŠŚlÅ═(f©┤)╚╝Ą─ÜŌ¾w └Ł═▀ÕaīŹ(sh©¬)“×(y©żn)
2H2O 2H2↑+O2↑ ╦«═©ļŖĘųĮŌ×ķÜõÜŌ║═č§ÜŌ ļŖĮŌ╦«
Cu2(OH)2CO3

2CuO+H2O+CO2↑ŠG╔½ūā║┌╔½�Īóįć╣▄▒┌ėąę║¾wĪó╩╣╩»╗ę╦«ūā£åØßÜŌ¾w Ń~ŠG╝ė¤ß
NH4HCO3

NH3↑+H2O+CO2↑░ū╔½╣╠¾wŽ¹╩¦�����Īó╣▄▒┌ėąę║¾wĪó╩╣╩»╗ę╦«ūā£åØßÜŌ¾w ╠╝╦ßÜõõ@ķL(zh©Żng)Ų┌▒®┬Č┐šÜŌųąĢ■(hu©¼)Ž¹╩¦
Zn+H2SO4==ZnSO4+H2↑ ėą┤¾┴┐ÜŌ┼▌«a(ch©Żn)╔·�����Īóõ\┴ŻųØu╚▄ĮŌ īŹ(sh©¬)“×(y©żn)╩ęųŲéõÜõÜŌ
Fe+H2SO4==FeSO4+H2↑ėą┤¾┴┐ÜŌ┼▌«a(ch©Żn)╔·�����ĪóĮī┘Ņw┴ŻųØu╚▄ĮŌ
Mg+H2SO4==MgSO4+H2↑ėą┤¾┴┐ÜŌ┼▌«a(ch©Żn)╔·����ĪóĮī┘Ņw┴ŻųØu╚▄ĮŌ
2Al+3H2SO4==Al2(SO4)3+3H2↑ėą┤¾┴┐ÜŌ┼▌«a(ch©Żn)╔·ĪóĮī┘Ņw┴ŻųØu╚▄ĮŌ
Fe2O3+3H2

2Fe+3H2O ╝t╔½ųØuūā?y©Łu)ķŃy░ū╔½����Īóįć╣▄▒┌ėąę║¾w ę▒¤ÆĮī┘Īó└¹ė├ÜõÜŌĄ─▀ĆįŁąį
Fe3O4+4H2

3Fe+4H2O ║┌╔½ųØuūā?y©Łu)ķŃy░ū╔½����Īóįć╣▄▒┌ėąę║¾w ę▒¤ÆĮī┘Īó└¹ė├ÜõÜŌĄ─▀ĆįŁąį
WO3+3H2

W+3H2O ę▒¤ÆĮī┘µu�����Īó└¹ė├ÜõÜŌĄ─▀ĆįŁąį
MoO3+3H2

Mo+3H2O ę▒¤ÆĮī┘Ńf�����Īó└¹ė├ÜõÜŌĄ─▀ĆįŁąį
2Na+Cl2

2NaCl äĪ┴ę╚╝¤²Īó³S╔½╗čµ ļxūė╗»║Ž╬’Ą─ą╬│╔�����ĪóH2+Cl22HCl ╔n░ū╔½╗čµ�ĪóŲ┐┐┌░ūņF ╣▓ār(ji©ż)╗»║Ž╬’Ą─ą╬│╔ĪóųŲéõ¹}╦ßCuSO4+2NaOH=Cu(OH)2↓+Na2SO4 ╦{(l©ón)╔½│┴ĄĒ╔·│╔�����Īó╔Ž▓┐×ķ│╬ŪÕ╚▄ę║ ┘|(zh©¼)┴┐╩ž║ŃČ©┬╔īŹ(sh©¬)“×(y©żn)
2C+O2

2CO├║Ātųą│ŻęŖĘ┤æ¬(y©®ng)�����Īó┐šÜŌ╬█╚Š╬’ų«ę╗�����Īó├║ÜŌųąČŠįŁę“
2CO+O2

2CO2╦{(l©ón)╔½╗čµ ├║ÜŌ╚╝¤²
C+CuO

2Cu+CO2↑║┌╔½ųØuūā?y©Łu)ķ╝t╔½����Īó«a(ch©Żn)╔·╩╣│╬ŪÕ╩»╗ę╦«ūā£åØߥ─ÜŌ¾w ę▒¤ÆĮī┘
2Fe2O3+3C

4Fe+3CO2↑ę▒¤ÆĮī┘
Fe3O4+2C

3Fe+2CO2↑ę▒¤ÆĮī┘
C+CO2

2CO
CO2+H2O==H2CO3╠╝╦ß╩╣╩»╚’ūā╝t ūC├„╠╝╦ߥ─╦ßąį
H2CO3

CO2↑+H2O╩»╚’╝t╔½═╩╚ź
Ca(OH)2+CO2==CaCO3↓+H2O│╬ŪÕ╩»╗ę╦«ūā£åØß æ¬(y©®ng)ė├CO2Öz“×(y©żn)║═╩»╗ęØ{Ę█╦óē”▒┌
CaCO3+H2O+CO2==Ca(HCO3)2░ū╔½│┴ĄĒųØu╚▄ĮŌ ╚▄Č┤Ą─ą╬│╔�����Ż¼╩»Ņ^Ą─’L(f©źng)╗»
Ca(HCO3)2

CaCO3↓+H2O+CO2↑░ū╔½│┴ĄĒĪó«a(ch©Żn)╔·╩╣│╬ŪÕ╩»╗ę╦«ūā£åØߥ─ÜŌ¾w ╦«╣Ėą╬│╔.ńŖ╚ķ╩»Ą─ą╬│╔
2NaHCO3

Na2CO3+H2O+CO2↑«a(ch©Żn)╔·╩╣│╬ŪÕ╩»╗ę╦«ūā£åØߥ─ÜŌ¾w ąĪ╠K┤“š¶zŅ^
CaCO3

CaO+CO2↑╣żśI(y©©)ųŲéõČ■č§╗»╠╝║═╔·╩»╗ę
CaCO3+2HCl==CaCl2+H2O+CO2↑╣╠¾wųØu╚▄ĮŌ����Īóėą╩╣│╬ŪÕ╩»╗ę╦«ūā£åØߥ─ÜŌ¾w īŹ(sh©¬)“×(y©żn)╩ęųŲéõČ■č§╗»╠╝Īó│²╦«╣Ė
Na2CO3+H2SO4==Na2SO4+H2O+CO2↑╣╠¾wųØu╚▄ĮŌ�����Īóėą╩╣│╬ŪÕ╩»╗ę╦«ūā£åØߥ─ÜŌ¾w ┼▌─Ł£ń╗Ų„įŁ└Ē
Na2CO3+2HCl==2NaCl+H2O+CO2↑╣╠¾wųØu╚▄ĮŌ�Īóėą╩╣│╬ŪÕ╩»╗ę╦«ūā£åØߥ─ÜŌ¾w ┼▌─Ł£ń╗Ų„įŁ└Ē
MgCO3+2HCl==MgCl2+H2O+CO2↑╣╠¾wųØu╚▄ĮŌĪóėą╩╣│╬ŪÕ╩»╗ę╦«ūā£åØߥ─ÜŌ¾w
CuO+CO

Cu+CO2║┌╔½ųØuūā╝t╔½�����Ż¼«a(ch©Żn)╔·╩╣│╬ŪÕ╩»╗ę╦«ūā£åØߥ─ÜŌ¾w ę▒¤ÆĮī┘
Fe2O3+3CO

2Fe+3CO2ę▒¤ÆĮī┘įŁ└Ē
Fe3O4+4CO

3Fe+4CO2ę▒¤ÆĮī┘įŁ└Ē
WO3+3CO W+3CO2ę▒¤ÆĮī┘įŁ└Ē
CH3COOH+NaOH=CH3COONa+H2O
2CH3OH+3O2 2CO2+4H2O
C2H5OH+3O2 2CO2+3H2O ╦{(l©ón)╔½╗čµ�Īó«a(ch©Żn)╔·╩╣╩»╗ę╦«ūā£åØߥ─ÜŌ¾wĪóĘ┼¤ß ŠŲŠ½Ą─╚╝¤²
Fe+CuSO4==Cu+FeSO4Ńy░ū╔½Įī┘▒Ē├µĖ▓╔wę╗īė╝t╔½╬’┘|(zh©¼) Ø±Ę©¤ÆŃ~�����ĪóÕāŃ~
Mg+FeSO4==Fe+MgSO4╚▄ę║ė╔£\ŠG╔½ūā?y©Łu)ķ¤o╔½ Cu+Hg(NO3)2==Hg+Cu(NO3)2
Cu+2AgNO3==2Ag+Cu(NO3)2╝t╔½Įī┘▒Ē├µĖ▓╔wę╗īėŃy░ū╔½╬’┘|(zh©¼) ÕāŃy
Zn+CuSO4==Cu+ZnSO4ŪÓ░ū╔½Įī┘▒Ē├µĖ▓╔wę╗īė╝t╔½╬’┘|(zh©¼) ÕāŃ~
Fe2O3+6HCl==2FeCl3+3H2OĶFõP╚▄ĮŌ�����Īó╚▄ę║│╩³S╔½ ĶFŲ„│²õP
Al2O3+6HCl==2AlCl3+3H2O░ū╔½╣╠¾w╚▄ĮŌ
Na2O+2HCl==2NaCl+H2O░ū╔½╣╠¾w╚▄ĮŌ
CuO+2HCl==CuCl2+H2O║┌╔½╣╠¾w╚▄ĮŌĪó╚▄ę║│╩╦{(l©ón)╔½
ZnO+2HCl==ZnCl2+H2O░ū╔½╣╠¾w╚▄ĮŌ
MgO+2HCl==MgCl2+H2O░ū╔½╣╠¾w╚▄ĮŌ
CaO+2HCl==CaCl2+H2O░ū╔½╣╠¾w╚▄ĮŌ
NaOH+HCl==NaCl+H2O░ū╔½╣╠¾w╚▄ĮŌ
Cu(OH)2+2HCl==CuCl2+2H2O╦{(l©ón)╔½╣╠¾w╚▄ĮŌ
Mg(OH)2+2HCl==MgCl2+2H2O░ū╔½╣╠¾w╚▄ĮŌ
Al(OH)3+3HCl==AlCl3+3H2O░ū╔½╣╠¾w╚▄ĮŌ ╬Ė╩µŲĮų╬»¤╬Ė╦ß▀^ČÓ
Fe(OH)3+3HCl==FeCl3+3H2O╝t║ų╔½│┴ĄĒ╚▄ĮŌ�����Īó╚▄ę║│╩³S╔½
Ca(OH)2+2HCl==CaCl2+2H2O
HCl+AgNO3==AgCl↓+HNO3 ╔·│╔░ū╔½│┴ĄĒ�����Īó▓╗╚▄ĮŌė┌ŽĪŽ§╦ß Öz“×(y©żn)Cl— Ą─įŁ└Ē
Fe2O3+3H2SO4= Fe2(SO4)3+3H2O ĶFõP╚▄ĮŌ�����Īó╚▄ę║│╩³S╔½ ĶFŲ„│²õP
Al2O3+3H2SO4==Al2(SO4)3+3H2O░ū╔½╣╠¾w╚▄ĮŌ
CuO+H2SO4==CuSO4+H2O║┌╔½╣╠¾w╚▄ĮŌ����Īó╚▄ę║│╩╦{(l©ón)╔½
ZnO+H2SO4==ZnSO4+H2O░ū╔½╣╠¾w╚▄ĮŌ
MgO+H2SO4==MgSO4+H2O░ū╔½╣╠¾w╚▄ĮŌ
2NaOH+H2SO4==Na2SO4+2H2O
Cu(OH)2+H2SO4==CuSO4+2H2O╦{(l©ón)╔½╣╠¾w╚▄ĮŌ
Ca(OH)2+H2SO4==CaSO4+2H2O
Mg(OH)2+H2SO4==MgSO4+2H2O░ū╔½╣╠¾w╚▄ĮŌ
2Al(OH)3+3H2SO4==Al2(SO4)3+3H2O░ū╔½╣╠¾w╚▄ĮŌ
2Fe(OH)3+3H2SO4==Fe2(SO4)3+3H2O╝t║ų╔½│┴ĄĒ╚▄ĮŌ�����Īó╚▄ę║│╩³S╔½
Ba(OH)2+H2SO4==BaSO4↓+2H2O ╔·│╔░ū╔½│┴ĄĒ�Īó▓╗╚▄ĮŌė┌ŽĪŽ§╦ß Öz“×(y©żn)SO42—Ą─įŁ└Ē
BaCl2+H2SO4==BaSO4↓+2HCl╔·│╔░ū╔½│┴ĄĒĪó▓╗╚▄ĮŌė┌ŽĪŽ§╦ß Öz“×(y©żn)SO42—Ą─įŁ└Ē
Ba(NO3)2+H2SO4==BaSO4↓+2HNO3 ╔·│╔░ū╔½│┴ĄĒ�Īó▓╗╚▄ĮŌė┌ŽĪŽ§╦ß Öz“×(y©żn)SO42—Ą─įŁ└Ē
Na2O+2HNO3==2NaNO3+H2O░ū╔½╣╠¾w╚▄ĮŌ
CuO+2HNO3==Cu(NO3)2+H2O║┌╔½╣╠¾w╚▄ĮŌĪó╚▄ę║│╩╦{(l©ón)╔½
ZnO+2HNO3==Zn(NO3)2+H2O░ū╔½╣╠¾w╚▄ĮŌ
MgO+2HNO3==Mg(NO3)2+H2O░ū╔½╣╠¾w╚▄ĮŌ
CaO+2HNO3==Ca(NO3)2+H2O░ū╔½╣╠¾w╚▄ĮŌ
NaOH+HNO3==NaNO3+H2O
Cu(OH)2+2HNO3==Cu(NO3)2+2H2O╦{(l©ón)╔½╣╠¾w╚▄ĮŌ
Mg(OH)2+2HNO3==Mg(NO3)2+2H2O░ū╔½╣╠¾w╚▄ĮŌ
Al(OH)3+3HNO3==Al(NO3)3+3H2O░ū╔½╣╠¾w╚▄ĮŌ
Ca(OH)2+2HNO3==Ca(NO3)2+2H2O
Fe(OH)3+3HNO3==Fe(NO3)3+3H2O╝t║ų╔½│┴ĄĒ╚▄ĮŌ�����Īó╚▄ę║│╩³S╔½
3NaOH+H3PO4==3H2O+Na3PO4
3NH3+H3PO4==(NH4)3PO4
2NaOH+CO2==Na2CO3+H2O ╬³╩šCOĪóO2�����ĪóH2ųąĄ─CO2
2NaOH+SO2==Na2SO3+H2O 2NaOH+SO3==Na2SO4+H2O ╠Ä└Ē┴“╦ß╣żÅSĄ─╬▓ÜŌ(SO2)
FeCl3+3NaOH==Fe(OH)3↓+3NaCl ╚▄ę║³S╔½═╩╚ź�Īóėą╝t║ų╔½│┴ĄĒ╔·│╔
AlCl3+3NaOH==Al(OH)3↓+3NaClėą░ū╔½│┴ĄĒ╔·│╔
MgCl2+2NaOH==Mg(OH)2↓+2NaCl
CuCl2+2NaOH==Cu(OH)2↓+2NaCl╚▄ę║╦{(l©ón)╔½═╩╚źĪóėą╦{(l©ón)╔½│┴ĄĒ╔·│╔
CaO+ H2O==Ca(OH)2░ū╔½ēKĀŅ╣╠¾wūā?y©Łu)ķĘ█─®Ī?╔·╩»╗ęųŲéõ╩»╗ęØ{
Ca(OH)2+SO2==CaSO3↓+H2Oėą░ū╔½│┴ĄĒ╔·│╔ │§ųąę╗░Ń▓╗ė├
Ca(OH)2+Na2CO3==CaCO3↓+2NaOHėą░ū╔½│┴ĄĒ╔·│╔ ╣żśI(y©©)ųŲ¤²ēA�����ĪóīŹ(sh©¬)“×(y©żn)╩ęųŲ╔┘┴┐¤²ēA
Ba(OH)2+Na2CO3==BaCO3↓+2NaOHėą░ū╔½│┴ĄĒ╔·│╔
Ca(OH)2+K2CO3==CaCO3↓+2KOHėą░ū╔½│┴ĄĒ╔·│╔
CuSO4+5H2O==CuSO4·H2O╦{(l©ón)╔½Š¦¾wūā?y©Łu)ķ░ū╔½Ę█─?/p>
CuSO4+H2O CuSO4+5H2O ░ū╔½Ę█─®ūā?y©Łu)ķ╦{(l©ón)╔½ Öz“×(y©żn)╬’┘|(zh©¼)ųą╩Ūʱ║¼ėą╦«
AgNO3+NaCl==AgCl↓+NaNO3░ū╔½▓╗╚▄ĮŌė┌ŽĪŽ§╦ߥ─│┴ĄĒ(Ųõ╦¹┬╚╗»╬’ŅÉ╦ŲĘ┤æ¬(y©®ng)) æ¬(y©®ng)ė├ė┌Öz“×(y©żn)╚▄ę║ųąĄ─┬╚ļxūė
BaCl2+Na2SO4==BaSO4↓+2NaCl░ū╔½▓╗╚▄ĮŌė┌ŽĪŽ§╦ߥ─│┴ĄĒ(Ųõ╦¹┴“╦ß¹}ŅÉ╦ŲĘ┤æ¬(y©®ng)) æ¬(y©®ng)ė├ė┌Öz“×(y©żn)┴“╦ßĖ∙ļxūė
CaCl2+Na2CO3==CaCO3↓+2NaClėą░ū╔½│┴ĄĒ╔·│╔
MgCl2+Ba(OH)2==BaCl2+Mg(OH)2↓ėą░ū╔½│┴ĄĒ╔·│╔
CaCO3+2HCl==CaCl2+H2O+CO2↑
MgCO3+2HCl==MgCl2+H2O+ CO2↑
NH4NO3+NaOH==NaNO3+NH3↑+H2O╔·│╔╩╣?ji©”)±Ø?r©┤n)╩»╚’įć╝łūā╦{(l©ón)╔½Ą─ÜŌ¾w æ¬(y©®ng)ė├ė┌Öz“×(y©żn)╚▄ę║ųąĄ─õ@Ė∙ļxūė
NH4Cl+KOH==KCl+NH3↑+H2O╔·│╔╩╣?ji©”)±Ø?r©┤n)╩»╚’įć╝łūā╦{(l©ón)╔½Ą─ÜŌ¾w
ĪĪĪĪ ÜgėŁ╩╣ė├╩ųÖC(j©®)����ĪóŲĮ░ÕĄ╚ęŲäė(d©░ng)įO(sh©©)éõįLå¢ųą┐╝ŠW(w©Żng)Ż¼2024ųą┐╝ę╗┬Ę┼Ń░ķ═¼ąą����ŻĪ>>³c(di©Żn)ō¶▓ķ┐┤








