1F
┐╝³cę╗Ż║Įī┘▓─┴Ž
(ę╗)Īó╝āĮī┘▓─┴ŽŻ║╝āĮī┘(90ČÓĘN)

(Č■)Īó║ŽĮ(ÄūŪ¦ĘN)Ż║ė╔ę╗ĘNĮī┘Ė·Ųõ╦¹ę╗ĘN╗“ÄūĘNĮī┘(╗“Įī┘┼cĘŪĮī┘)ę╗Ų╚█║ŽČ°│╔Ą─Š▀ėąĮī┘╠žąįĄ─╬’┘|(zh©¼)����ĪŻ
1. Įī┘▓─┴Ž░³└©╝āĮī┘║═║ŽĮā╔ŅÉ�����ĪŻĮī┘ī┘ė┌Įī┘▓─┴ŽŻ¼Ą½Įī┘▓─┴Ž▓╗ę╗Č©╩Ū╝āĮī┘���Ż¼ę▓┐╔─▄╩Ū║ŽĮ����ĪŻ
2. ║ŽĮ┐╔─▄╩ŪĮī┘┼cĮī┘ĮM│╔����Ż¼ę▓┐╔─▄╩ŪĮī┘┼cĘŪĮī┘ĮM│╔ĪŻĮī┘▓─┴Žųą╩╣ė├▒╚▌^ÅVĘ║Ą─╩Ū║ŽĮ�����ĪŻ
║ŽĮĄ─ā×(y©Łu)³cŻ║
(1)╚█³cĖ▀�Īó├▄Č╚ąĪ;(2)┐╔╦▄ąį║├Īóęūė┌╝ė╣ż����ĪóÖCąĄąį─▄║├;(3)┐╣Ė»╬gąį─▄║├;
Ž┬├µ╩Ū³SŃ~║═Ń~Ų¼Ż¼║ĖÕa║═Õa����Ż¼õX║ŽĮ║═õXŠĆĄ─ėąĻP(gu©Īn)ąį┘|(zh©¼)▒╚▌^Ż║
Ōü║ŽĮĄ─ā×(y©Łu)³cŻ║ó┘ ╚█³cĖ▀�����Īó├▄Č╚ą���ĪŻ╗ó┌ ┐╔╦▄ąį║├���Īóęūė┌╝ė╣żĪóÖCąĄąį─▄║├�����Ż╗ó█ ┐╣Ė»╬gąį─▄║├
Ōü║═Ōü║ŽĮŻ║▒╗šJ×ķ╩Ū21╩└╝oĄ─ųžę¬Įī┘▓─┴Ž��Ż¼Ōü║ŽĮ┼c╚╦¾wėą║▄║├Ą─“ŽÓ╚▌ąį”�����Ż¼ę“┤╦┐╔ė├üĒųŲįņ╚╦įņ╣ŪĄ╚���ĪŻ
Ōüµć║ŽĮŠ▀ėą“ėøæø”─▄┴”���Ż¼┐╔ėøūĪ─│éĆ╠žČ©£žČ╚Ž┬Ą─ą╬ĀŅ��Ż¼ų╗ę¬Å═╗ž▀@éĆ£žČ╚��Ż¼Š═Ģ■╗ųÅ═ĄĮ▀@éĆ£žČ╚Ž┬Ą─ą╬ĀŅ��Ż¼ėų▒╗ĘQ×ķ“ėøæøĮī┘”�����ĪŻ┤╦═Ō�����Ż¼Ōü▀Ć┐╔ųŲ╚Ī│¼ī¦▓─┴Ž���Ż¼├└ć°╔·«a(ch©Żn)Ą─│¼ī¦▓─┴ŽųąĄ─90%╩Ūė├ŌüŌē║ŽĮųŲįņĄ─ĪŻ
3. ūóęŌŻ║(1)║ŽĮ╩ŪĮī┘┼cĮī┘╗“Įī┘┼cĘŪĮī┘Ą─╗ņ║Ž╬’���ĪŻ(2)║ŽĮĄ─║▄ČÓąį─▄┼cĮM│╔╦³éāĄ─╝āĮī┘▓╗═¼���Ż¼╩╣║ŽĮĖ³╚▌ęū▀mė┌▓╗═¼Ą─ė├═ŠĪŻ(3)╚š│Ż╩╣ė├Ą─Įī┘▓─┴ŽŻ¼┤¾ČÓöĄ(sh©┤)×ķ║ŽĮ�����ĪŻ(4)Įī┘į┌╚█║Ž┴╦Ųõ╦³Įī┘║═ĘŪĮī┘║¾����Ż¼▓╗āHĮM│╔╔Ž░l(f©Ī)╔·┴╦ūā╗»Ż¼Ųõā╚(n©©i)▓┐ĮM│╔ĮY(ji©”)śŗ(g©░u)ę▓░l(f©Ī)╔·┴╦Ė─ūā��Ż¼Å─Č°ę²Ųąį┘|(zh©¼)Ą─ūā╗»�ĪŻ
4. 2.║ŽĮĄ─ą╬│╔Śl╝■Ż║Ųõųą╚╬ę╗Įī┘Ą─╚█³c▓╗─▄Ė▀ė┌┴Ēę╗Įī┘Ą─Ęą³c(«öā╔ĘNĮī┘ą╬│╔║ŽĮĢr)ĪŻ
5. ŪÓŃ~╩Ū╚╦ŅÉÜv╩Ę╔Ž╩╣ė├ūŅįńĄ─║ŽĮ;╔·ĶF║═õō╩Ū╚╦ŅÉ└¹ė├ūŅÅVĘ║Ą─║ŽĮ.
6. ║ŽĮČ╝ī┘ė┌╗ņ║Ž╬’�ĪŻ
2F
┐╝³c2Ż║Įī┘Ą─╬’└Ēąį┘|(zh©¼)
(1)│Ż£žŽ┬ę╗░Ń×ķ╣╠æB(t©żi)(╣»×ķę║æB(t©żi))Ż¼ėąĮī┘╣ŌØ╔����ĪŻ(2)┤¾ČÓöĄ(sh©┤)│╩Ńy░ū╔½(Ń~×ķūŽ╝t╔½��Ż¼Į×ķ³S╔½)(3)ėą┴╝║├Ą─ī¦¤ßąį��Īóī¦ļŖąį���Īóčėš╣ąį(4)├▄Č╚║═ė▓Č╚▌^┤¾�Ż¼╚█Ęą³c▌^Ė▀ĪŻ ūóŻ║Įī┘Ą─╬’└Ēąį┘|(zh©¼)╩Ūų╗╦∙ėąĮī┘Č╝ėąĄ─╣▓═¼ąį┘|(zh©¼)�����Ż¼Č°▓╗╩ŪųĖ─│ę╗Įī┘Ą─╠žėąąį┘|(zh©¼)���ĪŻ
3F
┐╝³c3 Ż║Įī┘ų«ūŅ
(1)õXŻ║ĄžÜżųą║¼┴┐ūŅČÓĄ─Įī┘į¬╦ž (2)Ō}Ż║╚╦¾wųą║¼┴┐ūŅČÓĄ─Įī┘į¬╦ž(3)ĶFŻ║─┐Ū░╩└Įń─Ļ«a(ch©Żn)┴┐ūŅČÓĄ─Įī┘(ĶF>õX>Ń~)(4)ŃyŻ║ī¦ļŖ���Īóī¦¤ßąįūŅ║├Ą─Įī┘(Ńy>Ń~>Į>õX)(5)ŃtŻ║ė▓Č╚ūŅĖ▀Ą─Įī┘ (6)µuŻ║╚█³cūŅĖ▀Ą─Įī┘(7)╣»Ż║╚█³cūŅĄ═Ą─Įī┘ (8)õ~Ż║├▄Č╚ūŅ┤¾Ą─Įī┘(9)õć Ż║├▄Č╚ūŅąĪĄ─Įī┘
4F
┐╝³c4Ż║Įī┘┼cč§ÜŌĄ─Ę┤æ¬(y©®ng)
5F
┐╝³c5Ż║Įī┘┼c╦ߥ─Ę┤æ¬(y©®ng)
6F
┐╝³c6Ż║ī┘┼c╗»║Ž╬’╚▄ę║Ą─Ę┤æ¬(y©®ng)
7F
┐╝³c 7 Ż║ų├ōQĘ┤æ¬(y©®ng)
ų├ōQĘ┤æ¬(y©®ng)Ż║ė╔ę╗ĘNå╬┘|(zh©¼)┼cę╗ĘN╗»║Ž╬’Ę┤æ¬(y©®ng)Ż¼╔·│╔┴Ēę╗ĘNå╬┘|(zh©¼)┼c╗»║Ž╬’Ą─Ę┤æ¬(y©®ng)Įąū÷ų├ōQĘ┤æ¬(y©®ng)��ĪŻ
8F
┐╝³c8 Ż║Įī┘╗ŅäėąįĒśą“
1���Īó│ŻęŖĮī┘Ą─╗ŅäėąįĒśą“Ż║
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
2���ĪóęŌ┴xŻ║ó┘H┤·▒Ē╦ßųąĄ─Üõį¬╦ž;ó┌Įī┘Ą─╬╗ų├įĮ┐┐Ū░Ż¼╦³Ą─╗Ņäė

ąįŠ═įĮÅŖ;ó█į┌Įī┘╗ŅäėąįĒśą“└’��Ż¼╬╗ė┌ÜõŪ░├µĄ─Įī┘─▄ų├ōQ│÷¹}╦ß��ĪóŽĪ┴“╦ßųąĄ─Üõ(▓╗┐╔ė├ØŌ┴“╦ß����ĪóŽ§╦ß);ó▄╬╗ė┌Ū░├µĄ─Įī┘─▄░č╬╗ė┌║¾├µĄ─Įī┘Å─╦³éāĄ─¹}╚▄ę║ųąų├ōQ│÷üĒĪŻ(│²KĪóCa���ĪóNa)
3��Īóæ¬(y©®ng)ė├Ż║ó┘ė├ė┌┼ąöÓĮī┘╩Ūʱ┼c╦ß░l(f©Ī)╔·ų├ōQĘ┤æ¬(y©®ng);ó┌ė├ė┌┼ąöÓĮī┘┼c╦ß░l(f©Ī)╔·╗»īWĘ┤æ¬(y©®ng)Ą─äĪ┴ę│╠Č╚;ó█ė├ė┌┼ąöÓĮī┘┼c¹}─▄ʱ░l(f©Ī)╔·ų├ōQĘ┤æ¬(y©®ng)��ĪŻ
ūóęŌŻ║
1�����ĪóĮī┘┼c¹}Ą─Ę┤æ¬(y©®ng)▒žĒÜį┌“¹}╚▄ę║”ųą▀Mąą���Ż¼Ę±ät▓╗─▄Ę┤æ¬(y©®ng)Ż¼╚ńŻ║Cu┐╔ęį┼cAgNO3╚▄ę║Ę┤æ¬(y©®ng)ų├ōQ│÷Ag��Ż¼Ą½▓╗─▄┼cAgClĘ┤æ¬(y©®ng)���ĪŻ
2����Īóę▓┐╔Ė∙ō■(j©┤)Ę┤æ¬(y©®ng)╩Ūʱ░l(f©Ī)╔·╝░Ę┤æ¬(y©®ng)äĪ┴ę│╠Č╚üĒ┼ąöÓĮī┘Ą─╗ŅäėąįÅŖ╚§���ĪŻ
3ĪóKĪóCa�����ĪóNa╚²ĘNĮī┘Ą─╗Ņäėąį╠½ÅŖ����Ż¼│²┼c╦ßĘ┤æ¬(y©®ng)═ŌŻ¼▀Ć─▄┼c╦«į┌│Ż£žŽ┬░l(f©Ī)╔·ų├ōQĘ┤æ¬(y©®ng)(╚ń2Na+2H2O=2NaOH+H2↑)���Ż¼ŲõėÓĮī┘ät▓╗─▄
9F
┐╝³c9Ż║ĄV╩»
1. Įī┘┘Yį┤Ą─┤µį┌ĘĮ╩ĮŻ║ĄžŪ“╔ŽĄ─Įī┘┘Yį┤ÅVĘ║┤µį┌ė┌ĄžÜż║═║Żč¾ųą��Ż¼┤¾ČÓöĄ(sh©┤)Įī┘╗»║Ž╬’ąį┘|(zh©¼)▌^╗ŅØŖ����Ż¼╦∙ęį╦³éāęį╗»║Ž╬’Ą─ą╬╩Į┤µį┌;ų╗ėą╔┘öĄ(sh©┤)Įī┘╗»īWąį┘|(zh©¼)║▄▓╗╗ŅØŖ�Ż¼╚ńĮĪóŃyĄ╚ęįå╬┘|(zh©¼)ą╬╩Į┤µį┌���ĪŻ
2. ĄV╩»Ż║╣żśI(y©©)╔Ž░č─▄╠ߤÆĮī┘Ą─ĄV╬’ĮąĄV╩»���ĪŻ
3. │ŻęŖĄV╩»├¹ĘQ┼cŲõų„ę¬│╔ĘųŻ║
10F
┐╝³c10Ż║ę╗č§╗»╠╝▀ĆįŁč§╗»ĶF
1Īó¤ÆĶFĄ─╗∙▒ŠįŁ└Ē╩ŪŻ║į┌Ė▀£žŚl╝■Ž┬���Ż¼└¹ė├Į╣╠┐┼cč§ÜŌĘ┤æ¬(y©®ng)╔·│╔Ą─ę╗č§╗»╠╝░čĶFÅ─ĶFĄV╩»└’▀ĆįŁ│÷üĒ��ĪŻ3CO + Fe2O3
Ė▀£ž
2Fe + 3CO2
2���Īó¤ÆĶFĄ─įŁ┴ŽŻ║ĶFĄV╩»[│ŻęŖĄ─ĶFĄV╩»ėą┤┼ĶFĄV(ų„ę¬│╔Ęų╩ŪFe3O4)║═│ÓĶFĄV(ų„ę¬│╔Ęų╩ŪFe2O3)]��ĪóĮ╣╠┐���Īó╩»╗ę╩»║═┐šÜŌŻ¼ų„ę¬įO(sh©©)éõ╩ŪĖ▀Āt����ĪŻ(1)āxŲ„Ż║ĶF╝▄┼_(2éĆ)Īóė▓┘|(zh©¼)▓Ż┴¦╣▄����Īóå╬┐ūŽŲż┘É(2éĆ)ĪóŠŲŠ½¤¶�Īóįć╣▄ĪóŠŲŠ½ćŖ¤¶���Īóļp┐ūŽŲż┘É�����Īóī¦ÜŌ╣▄��ĪŻ(2)╦ÄŲĘŻ║č§╗»ĶFĘ█─®��Īó│╬ŪÕ╩»╗ę╦«����Īóę╗č§╗»╠╝ÜŌ(3)čbų├łDŻ║
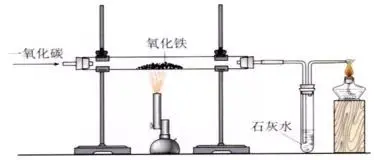
(4)▓Į¾EŻ║ó┘Öz“×čbų├Ą─ÜŌ├▄ąį;ó┌čb╚ļ╦ÄŲĘ▓ó╣╠Č©;ó█Ž“▓Ż┴¦╣▄ā╚(n©©i)═©╚ļę╗č§╗»╠╝ÜŌ¾w;ó▄Įoč§╗»ĶF╝ė¤ß;ó▌═Żų╣╝ė¤ß;ó▐═Żų╣═©╚ļę╗č§╗»╠╝���ĪŻ(5)¼F(xi©żn)Ž¾Ż║╝t╔½Ę█─®ųØuūā│╔║┌╔½�����Ż¼│╬ŪÕ╩»╗ę╦«ūā£åØß��Ż¼╬▓ÜŌ╚╝¤²«a(ch©Żn)╔·╦{╔½╗čµ����ĪŻ(6)╗»īWĘĮ│╠╩ĮŻ║

Ca(OH)2+CO2=CaCO3↓+H2O
(7)ūóęŌ╩┬ĒŚŻ║┼cCO▀ĆįŁč§╗»Ń~Ą─īŹ“×▓┘ū„Ēśą“ę╗śė���Ż¼╝┤Ž╚═©╚ļCOį┘╝ė¤ß���Ż¼īŹ“×═Ļ«ģ���Ż¼═Żų╣╝ė¤ßŻ¼└^└m(x©┤)═©╚ļCOų┴įć╣▄└õģs���ĪŻó┌����ĪóīŹ“×ų„ę¬¼F(xi©żn)Ž¾Ż║╝t╔½Ę█─®ūā?y©Łu)ķ║┌╔½Ģr��Ż¼│╬ŪÕĄ─╩»╗ę╦«ūā

£åØß����Ż¼╬▓ÜŌ³c╚╝«a(ch©Żn)╔·ĄŁ╦{╔½╗čµĪŻó█īŹ“×ūóęŌ╩┬ĒŚŻ║Ž╚─▄║¾³c���Ż¼Ž╚│Ę║¾═Ż

���ĪŻ
(8)╬▓ÜŌ╠Ä└ĒŻ║ę“COėąČŠŻ¼▓╗─▄ļSęŌ┼┼Ę┼į┌┐šÜŌųą����Ż¼╠Ä└ĒĄ─įŁät╩ŪīóCO╚╝¤²Ą¶▐D(zhu©Żn)╗»×ķ¤oČŠĄ─CO2╗“╩š╝»éõė├ĪŻ
ĪĪĪĪ ÜgėŁ╩╣ė├╩ųÖCĪóŲĮ░ÕĄ╚ęŲäėįO(sh©©)éõįLå¢ųą┐╝ŠW(w©Żng)���Ż¼2024ųą┐╝ę╗┬Ę┼Ń░ķ═¼ąą�����ŻĪ>>³cō¶▓ķ┐┤











