ŅľŁc(di®£n)1.ĹūĆŔ≤ńŃŌ
1.ĹūĆŔ≤ńŃŌįŁņ®ľÉĹūĆŔ(90∂ŗ∑N)ļÕļŌĹū(é◊«ß∑N)É…Óź°£
ĹūĆŔĆŔ”ŕĹūĆŔ≤ńŃŌ��£¨ĶęĹūĆŔ≤ńŃŌ≤Ľ“Ľ∂® «ľÉĹūĆŔ£¨“≤Ņ…ń‹ «ļŌĹū�����°£
2.ĹūĆŔ÷∆∆∑ «”…ĹūĆŔ≤ńŃŌ÷∆≥…Ķń���£¨ŤF°Ę„~��°ĘšXľį∆šļŌĹū «»ňÓź Ļ”√◊Ó∂ŗĶńĹūĆŔ≤ńŃŌ°£
ŅľŁc(di®£n)2. ĹūĆŔ≤ńŃŌĶńįl(f®°)’Ļ ∑
łýďĢ(j®ī)öv ∑ĶńĆW(xu®¶)Ńē(x®™)��£¨ő“āÉŅ…“‘÷™ĶņĹūĆŔ≤ńŃŌĶńįl(f®°)’ĻŖ^(gu®į)≥Ő����°£…Ő≥Į£¨»ňāÉť_(k®°i) ľ Ļ”√«ŗ„~∆ų;īļ«Ôēr(sh®™)∆ŕť_(k®°i) ľ“ĪŤF;Ďū(zh®§n)áÝ(gu®ģ)ēr(sh®™)∆ŕť_(k®°i) ľüíšď;„~ļÕŤF“Ľ÷Ī «»ňÓźŹV∑ļĎ™(y®©ng)”√ĶńĹūĆŔ≤ńŃŌ��°£‘ŕ100∂ŗńÍ«į�£¨”÷ť_(k®°i) ľŃňšXĶń Ļ”√£¨“ÚšXĺŖ”–√‹∂»–°ļÕŅĻłĮőgĶ»‘S∂ŗÉě(y®≠u)Ńľ–‘ń‹�£¨šXĶńģa(ch®£n)ŃŅ“—≥¨Ŗ^(gu®į)Ńň„~£¨őĽ”ŕĶŕ∂ĢőĽ�°£
ĹūĆŔ∑÷Óź£ļ÷ōĹūĆŔ£ļ»Á„~°Ęš\�°Ę„UĶ»
›pĹūĆŔ£ļ»Á‚c°ĘśV����°ĘšXĶ»;ļŕ…ęĹūĆŔ£ļÕ®≥£÷łŤF°ĘŚi���°Ę„tľįňŁāÉĶńļŌĹū��°£Fe�°ĘMn°ĘCr(„t)”–…ęĹūĆŔ£ļÕ®≥£ «÷ł≥żļŕ…ęĹūĆŔ“‘Õ‚Ķń∆šňŻĹūĆŔ���°£
ŅľŁc(di®£n)3 ĹūĆŔĶńőÔņŪ–‘Ŕ|(zh®¨)
1.Ļ≤–‘£ļīů∂ŗĒĶ(sh®ī)ĹūĆŔ∂ľĺŖ”–ĹūĆŔĻ‚Ě…��£¨√‹∂»ļÕ”≤∂»›^īů���£¨»Ř∑–Łc(di®£n)›^łŖ£¨ĺŖ”–Ńľļ√Ķń—”’Ļ–‘ļÕĆß(d®£o)Žä����°ĘĆß(d®£o)üŠ–‘£¨‘ŕ “úōŌ¬≥żĻĮěť“ļůw����£¨∆š”ŗĹūĆŔĺýěťĻŐůw°£
(1)≥£úōŌ¬“Ľį„ěťĻŐĎB(t®§i)(ĻĮěť“ļĎB(t®§i))��£¨”–ĹūĆŔĻ‚Ě…����°£
(2)īů∂ŗĒĶ(sh®ī)≥ „yį◊…ę(„~ěť◊Ōľt…ę£¨Ĺū읣S…ę)
(3)”–Ńľļ√ĶńĆß(d®£o)üŠ–‘�°ĘĆß(d®£o)Žä–‘���°Ę—”’Ļ–‘
2.“Ľ–©ĹūĆŔĶńŐō–‘£ļŤF�°ĘšXĶ»īů∂ŗĒĶ(sh®ī)ĹūĆŔ∂ľ≥ „yį◊…ę£¨„~≥ ◊Ōľt…ę����£¨Ĺū≥ ŁS…ę;≥£úōŌ¬īů∂ŗĒĶ(sh®ī)ĹūĆŔ∂ľ «ĻŐůw£¨ĻĮÖs «“ļůw;łų∑NĹūĆŔĶńĆß(d®£o)Žä–‘����°ĘĆß(d®£o)üŠ–‘°Ę√‹∂»����°Ę»ŘŁc(di®£n)°Ę”≤∂»Ķ»≤Óģź›^īů;„yĶńĆß(d®£o)Žä–‘ļÕĆß(d®£o)üŠ–‘◊Óļ√���£¨š~Ķń√‹∂»◊Óīů���£¨šáĶń√‹∂»◊Ó–°£¨śuĶń»ŘŁc(di®£n)◊ÓłŖ��£¨ĻĮĶń»ŘŁc(di®£n)◊ÓĶÕ���£¨„tĶń”≤∂»◊Óīů���°£
(1)šX£ļĶōö§÷–ļ¨ŃŅ◊Ó∂ŗĶńĹūĆŔ‘™ňō(1)‚}£ļ»ňůw÷–ļ¨ŃŅ◊Ó∂ŗĶńĹūĆŔ‘™ňō(1)ŤF£ļńŅ«į ņĹÁńÍģa(ch®£n)ŃŅ◊Ó∂ŗĶńĹūĆŔ(ŤF>šX>„~)(1)„y£ļĆß(d®£o)Žä��°ĘĆß(d®£o)üŠ–‘◊Óļ√ĶńĹūĆŔ(„y>„~>Ĺū>šX)
(1)„t£ļ”≤∂»◊ÓłŖĶńĹūĆŔ(1)śu£ļ»ŘŁc(di®£n)◊ÓłŖĶńĹūĆŔ(1)ĻĮ£ļ»ŘŁc(di®£n)◊ÓĶÕĶńĹūĆŔ(1)š~£ļ√‹∂»◊ÓīůĶńĹūĆŔ(1)šá £ļ√‹∂»◊Ó–°ĶńĹūĆŔ
ŔYŃŌĀŪ(l®Ęi)‘ī”ŕĺW(w®£ng)Ĺj(lu®į)���£¨Ō¬√ś «‘≠őńśúĹ”£¨ę@»°ŔYŃŌÕÍ’ŻłŖ«ŚŅ…īÚ”°įśĪĺ
ôzúy(c®®)“Ľ£ļĹūĆŔ≤ńŃŌ1.ĹūĆŔĶńőÔņŪ–‘Ŕ|(zh®¨)
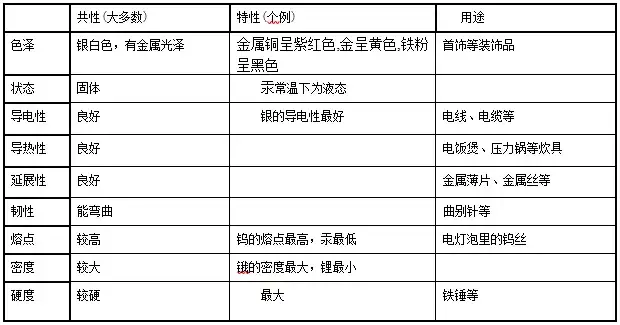
ŅľŁc(di®£n)4.őÔŔ|(zh®¨)Ķń–‘Ŕ|(zh®¨)ŇcőÔŔ|(zh®¨)Ķń”√Õĺ÷ģťgĶńÍP(gu®°n)ŌĶ
1.őÔŔ|(zh®¨)Ķń–‘Ŕ|(zh®¨)õQ∂®őÔŔ|(zh®¨)Ķń”√Õĺ���£¨∂ÝőÔŔ|(zh®¨)Ķń”√Õĺ”÷∑ī”≥≥ŲőÔŔ|(zh®¨)Ķń–‘Ŕ|(zh®¨)���°£
2.őÔŔ|(zh®¨)Ķń–‘Ŕ|(zh®¨)ļ‹īů≥Ő∂»…ŌõQ∂®ŃňőÔŔ|(zh®¨)Ķń”√Õĺ°£
ĶęŖ@≤Ľ «ő®“ĽĶńõQ∂®“Úňō����£¨‘ŕŅľĎ]őÔŔ|(zh®¨)Ķń”√Õĺēr(sh®™)£¨ŖÄ–Ť“™ŅľĎ]Ér(ji®§)łŮ���°ĘŔY‘ī���°Ę «∑Ů√ņ”^°Ę Ļ”√ «∑ŮĪ„ņŻ��£¨“‘ľįŹUŃŌ «∑Ů“◊”ŕĽō ’ļÕƶ(du®¨)≠h(hu®Ęn)ĺ≥Ķń”įŪĎĶ»∂ŗ∑N“Úňō°£
ŅľŁc(di®£n)5.ļŌĹū
1.ļŌĹū£ļ”…“Ľ∑NĹūĆŔłķ∆šňŻ“Ľ∑NĽÚé◊∑NĹūĆŔ(ĽÚĹūĆŔŇc∑«ĹūĆŔ)“Ľ∆ū»ŘļŌ∂Ý≥…ĶńĺŖ”–ĹūĆŔŐō–‘ĶńőÔŔ|(zh®¨)�°£‘ŕĹūĆŔ÷–ľ”üŠ»ŘļŌń≥–©ĹūĆŔļÕ∑«ĹūĆŔ£¨–ő≥…ĺŖ”–ĹūĆŔŐō–‘ĶńőÔŔ|(zh®¨)�°£
°Ô£ļ“Ľį„’f(shu®≠)ĀŪ(l®Ęi)���£¨ļŌĹūĶń»ŘŁc(di®£n)Ī»łų≥…∑÷ĶÕ�£¨”≤∂»Ī»łų≥…∑÷īů����£¨ŅĻłĮőg–‘ń‹łŁļ√°£
◊Ę“‚£ļ(1)ļŌĹū «ĹūĆŔŇcĹūĆŔĽÚĹūĆŔŇc∑«ĹūĆŔĶńĽžļŌőÔ��°£(2)ļŌĹūĶńļ‹∂ŗ–‘ń‹ŇcĹM≥…ňŁāÉĶńľÉĹūĆŔ≤ĽÕ¨�£¨ ĻļŌĹūłŁ»›“◊Ŗm”ŕ≤ĽÕ¨Ķń”√Õĺ°£(3)»’≥£ Ļ”√ĶńĹūĆŔ≤ńŃŌ�£¨īů∂ŗĒĶ(sh®ī)ěťļŌĹū°£(4)ĹūĆŔ‘ŕ»ŘļŌŃň∆šňŁĹūĆŔļÕ∑«ĹūĆŔļů�£¨≤ĽÉHĹM≥……Ōįl(f®°)…ķŃň◊ÉĽĮ£¨∆šÉ»(n®®i)≤ŅĹM≥…ĹY(ji®¶)ėč(g®įu)“≤įl(f®°)…ķŃňłń◊É����£¨Źń∂Ý“ż∆ū–‘Ŕ|(zh®¨)Ķń◊ÉĽĮ°£
2.ļŌĹūĶń–ő≥…ólľĢ£ļ∆š÷–»ő“ĽĹūĆŔĶń»ŘŁc(di®£n)≤Ľń‹łŖ”ŕŃŪ“ĽĹūĆŔĶń∑–Łc(di®£n)(ģĒ(d®°ng)É…∑NĹūĆŔ–ő≥…ļŌĹūēr(sh®™))���°£
3.ļŌĹūŇcĹM≥…ňŁāÉĶńľÉĹūĆŔ–‘Ŕ|(zh®¨)Ī»›^£ļ
Ō¬√ś «ŁS„~ļÕ„~∆¨��£¨ļłŚaļÕŚa�£¨šXļŌĹūļÕšXĺÄĶń”–ÍP(gu®°n)–‘Ŕ|(zh®¨)Ī»›^£ļ
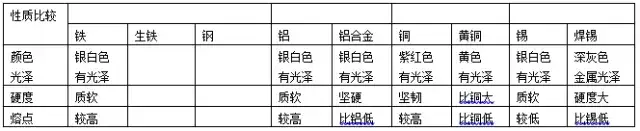
4.é◊∑N≥£“ä(ji®§n)ļŌĹū
(1)ŤFļŌĹū£ļ÷ų“™įŁņ®…ķŤFļÕšď£¨ňŁāÉĶńÖ^(q®Ī)Ąe «ļ¨ŐľŃŅ≤ĽÕ¨���£¨…ķŤFļ¨ŐľŃŅ2%-4.3%���£¨šďĶńļ¨ŐľŃŅěť0.03%—2%°£šďĪ»…ķŤFĺŖ”–łŁ∂ŗĶńÉě(y®≠u)Ńľ–‘ń‹��£¨“◊”ŕľ”Ļ§�£¨”√Õ峣읏V∑ļ°£≤ĽšPšď£ļļ¨„t��°ĘśáĶńšď
(2)šXļŌĹū£ļšX÷–ľ”»ŽśV�°Ę„~°Ęš\Ķ»ĹūĆŔ–ő≥…ļŌĹū�°£ŹV∑ļĎ™(y®©ng)”√”ŕ÷∆‘žÔwôC(j®©)°ĘŇěÕßļÕ›d÷ō∆Ż‹á(ch®•)Ķ»��£¨Ņ…‘Ųľ”ňŁāÉĶń›d÷ōŃŅ“‘ľįŐŠłŖŖ\(y®īn)––ňŔ∂»��£¨≤ĘĺŖ”–ŅĻļ£ňģłĮőg����°ĘĪ‹īŇ–‘Ķ»ŐōŁc(di®£n)�°£
(3)„~ļŌĹū£ļŁS„~£ļ„~��°Ęš\ĶńļŌĹū;«ŗ„~£ļ„~����°ĘŚaĶńļŌĹū;į◊„~£ļ„~��°ĘśáĶńļŌĹū���°£
(4)‚ĀļÕ‚ĀļŌĹū£ļĪĽ’J(r®®n)ěť «21 ņľo(j®¨)Ķń÷ō“™ĹūĆŔ≤ńŃŌ�£¨‚ĀļŌĹūŇc»ňůw”–ļ‹ļ√Ķń“Ōŗ»›–‘”��£¨ “ÚīňŅ…”√ĀŪ(l®Ęi)÷∆‘ž»ň‘žĻ«Ķ»����°£
Éě(y®≠u)Łc(di®£n)£ļĘŔ»ŘŁc(di®£n)łŖ°Ę√‹∂»–�°ĘŕŅ…ň‹–‘ļ√°Ę“◊”ŕľ”Ļ§�°ĘôC(j®©)–Ķ–‘ń‹ļ√ĘŘŅĻłĮőg–‘ń‹ļ√
–‘Ŕ|(zh®¨)£ļÉě(y®≠u)ģźĶńńÕłĮőg–‘£¨Ć¶(du®¨)ļ£ňģ�°ĘŅ’ö‚ļÕ»Űł…łĮőgĹťŔ|(zh®¨)∂ľ∑Ä(w®ßn)∂®����£¨Ņ…ň‹–‘ļ√����£¨Źä(qi®Ęng)∂»īů£¨√‹∂»–°��£¨”÷∑Q”H…ķőÔĹūĆŔ��°£
”√Õĺ£ļáäö‚ Ĺįl(f®°)Ą”(d®įng)ôC(j®©)���°ĘÔwôC(j®©)ôC(j®©)…Ū���°Ę»ň‘ž–l(w®®i)–«Õ‚ö§°ĘĽūľżö§ůw��°ĘŠt(y®©)ĆW(xu®¶)—a(b®≥)–ő��°Ę‘žľą��°Ę»ň‘žĻ«����°Ęļ£ňģĶ≠ĽĮ‘O(sh®®)āš�°Ęļ£›Ü��°ĘŇěÕßĶńÕ‚ö§Ķ»�°£
ŅľŁc(di®£n)6.ĹūĆŔŇc—űö‚Ķń∑īĎ™(y®©ng)
ĹūĆŔĶńĽĮĆW(xu®¶)–‘Ŕ|(zh®¨)£ļ1.īů∂ŗĒĶ(sh®ī)ĹūĆŔŅ…Ňc—űö‚Ķń∑īĎ™(y®©ng)
2.ĹūĆŔ + ňŠ → Ż} + H2↑
3.ĹūĆŔ + Ż} → ŃŪ“ĽĹūĆŔ + ŃŪ“ĽŻ} (ólľĢ£ļ“«įďQļů£¨Ż}Ņ…»‹”)
Fe + CuSO4 == Cu + FeSO4 (“ĚŮ∑®“ĪĹū”‘≠ņŪ )
ŅľŁc(di®£n)7.ĹūĆŔŇcňŠĶń∑īĎ™(y®©ng)

ŅľŁc(di®£n)8.ĹūĆŔŇcĽĮļŌőÔ»‹“ļĶń∑īĎ™(y®©ng)
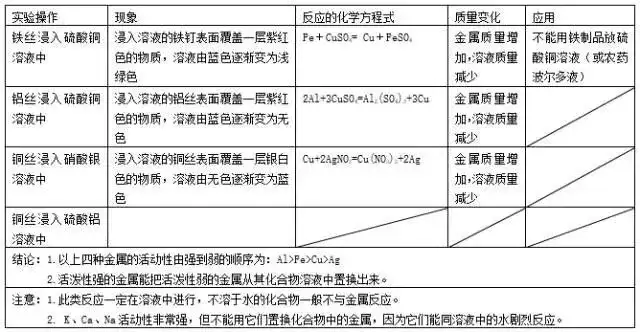
ŅľŁc(di®£n)9.÷√ďQ∑īĎ™(y®©ng)
÷√ďQ∑īĎ™(y®©ng)£ļ”…“Ľ∑NÜőŔ|(zh®¨)Ňc“Ľ∑NĽĮļŌőÔ∑īĎ™(y®©ng)����£¨…ķ≥…ŃŪ“Ľ∑NÜőŔ|(zh®¨)ŇcĽĮļŌőÔĶń∑īĎ™(y®©ng)Ĺ–◊Ų÷√ďQ∑īĎ™(y®©ng)°£
ŅľŁc(di®£n)10.ĹūĆŔĽÓĄ”(d®įng)–‘Ūė–Ú
»ňāÉÕ®Ŗ^(gu®į)īůŃŅĶńĆć(sh®™)Úě(y®§n)Úě(y®§n)◊CĶ√ĶĹ≥£“ä(ji®§n)ĹūĆŔĶńĽÓĄ”(d®įng)–‘Ūė–Ú£ļ
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
ĹūĆŔĽÓĄ”(d®įng)–‘£ļ”…Źä(qi®Ęng)ĶĹ»ű
Ď™(y®©ng)”√£ļ‘ŕĹūĆŔĽÓĄ”(d®įng)–‘Ūė–ÚņÔ���£¨ĹūĆŔĶńőĽ÷√‘ĹŅŅ«į����£¨ňŁĶńĽÓĄ”(d®įng)–‘‘ĹŹä(qi®Ęng)����°£
(1)‘ŕĹūĆŔĽÓĄ”(d®įng)–‘Ūė–ÚņÔ���£¨őĽ”ŕöš«į√śĶńĹūĆŔń‹÷√ďQ≥ŲŻ}ňŠ����°ĘŌ°ŃÚňŠ÷–Ķńöš(≤ĽŅ…”√Ě‚ŃÚňŠ���°ĘŌűňŠ)���°£
(2)‘ŕĹūĆŔĽÓĄ”(d®įng)–‘Ūė–ÚņÔ���£¨őĽ”ŕ«į√śĶńĹūĆŔń‹į—őĽ”ŕļů√śĶńĹūĆŔ?g®įu)ńňŁāÉĽĮļŌőÔĶń»‹“ļņÔ÷√ďQ≥ŲĀŪ(l®Ęi)(K°ĘCa�°ĘNa≥żÕ‚)°£
ŅľŁc(di®£n)11.ĶV Į
1. ĹūĆŔŔY‘īĶńīś‘ŕ∑Ĺ Ĺ£ļĶō«Ú…ŌĶńĹūĆŔŔY‘īŹV∑ļīś‘ŕ”ŕĶōö§ļÕļ£—ů÷–����£¨īů∂ŗĒĶ(sh®ī)ĹūĆŔĽĮļŌőÔ–‘Ŕ|(zh®¨)›^ĽÓĚ䣨ňý“‘ňŁāÉ“‘ĽĮļŌőÔĶń–ő Ĺīś‘ŕ;÷Ľ”–…ŔĒĶ(sh®ī)ĹūĆŔĽĮĆW(xu®¶)–‘Ŕ|(zh®¨)ļ‹≤ĽĽÓĚä�£¨»ÁĹū°Ę„yĶ»“‘ÜőŔ|(zh®¨)–ő Ĺīś‘ŕ��°£
2. ĶV Į£ļĻ§ėI(y®®)…Ōį—ń‹ŐŠüíĹūĆŔĶńĶVőÔĹ–ĶV Į��°£
3. ≥£“ä(ji®§n)ĶV Į√Ż∑QŇc∆š÷ų“™≥…∑÷£ļ
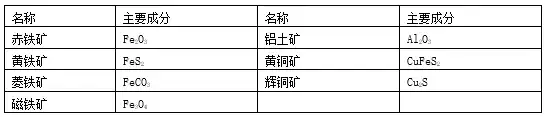
ŅľŁc(di®£n)12.“Ľ—űĽĮŐľŖÄ‘≠—űĽĮŤF
(1)Éx∆ų£ļŤFľ‹Ň_(t®Ęi)(2āÄ(g®®))����°Ę”≤Ŕ|(zh®¨)≤£ŃßĻ‹°ĘÜőŅ◊Ōū∆§Ŕź(2āÄ(g®®))���°Ęĺ∆ĺęüŰ���°Ę‘áĻ‹���°Ęĺ∆ĺęáäüŰ°ĘŽpŅ◊Ōū∆§Ŕź��°ĘĆß(d®£o)ö‚Ļ‹��°£
(2)ňé∆∑£ļ—űĽĮŤF∑Řń©���°Ę≥ő«Ś ĮĽ“ňģ��°Ę“Ľ—űĽĮŐľ?x®¨)‚ůw
(3)—b÷√ąD£ļ
(4)≤ĹůE£ļĘŔôzÚě(y®§n)—b÷√Ķńö‚√‹–‘;Ęŕ—b»Žňé∆∑≤ĘĻŐ∂®;ĘŘŌÚ≤£ŃßĻ‹É»(n®®i)Õ®»Ž“Ľ—űĽĮŐľ?x®¨)‚ůw;Ę‹Ĺo—űĽĮŤFľ”üŠ;Ę›Õ£÷Ļľ”üŠ;ĘřÕ£÷ĻÕ®»Ž“Ľ—űĽĮŐľ
(5)¨F(xi®§n)Ōů£ļľt…ę∑Řń©÷ūĚu◊É≥…ļŕ…ę���£¨≥ő«Ś ĮĽ“ňģ◊ÉúÜĚŠ��£¨ő≤ö‚»ľüżģa(ch®£n)…ķň{(l®Ęn)…ęĽū—ś����°£
(6)ĽĮĆW(xu®¶)∑Ĺ≥Ő Ĺ£ļ3CO+Fe2O3==łŖúō==2Fe+3CO2 2CO+O2==Łc(di®£n)»ľ===2CO2 Ca(OH)2+CO2=====CaCO3↓+H2O
(7)◊Ę“‚ ¬Ūó(xi®§ng)£ļ“™Ō»Õ®»ŽCO‘Ŕľ”üŠ£¨Ćć(sh®™)Úě(y®§n)ÕÍģÖ��£¨Õ£÷Ļľ”üŠ���£¨ņ^ņm(x®ī)Õ®»ŽCO÷Ń‘áĻ‹ņšÖs�°£
(8)ő≤ö‚ŐéņŪ£ļ“ÚCO”–∂ĺ£¨≤Ľń‹ŽS“‚ŇŇ∑Ň‘ŕŅ’ö‚÷–����£¨ŐéņŪĶń‘≠Ąt «ĆĘCO»ľüżĶŰřD(zhu®£n)ĽĮěťüo(w®≤)∂ĺĶńCO2ĽÚ ’ľĮāš”√°£
ŅľŁc(di®£n)13.Ļ§ėI(y®®)üíŤF
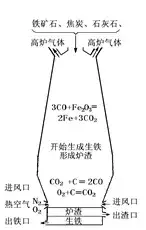
(1)‘≠ņŪ£ļ‘ŕłŖúōŌ¬����£¨ņŻ”√ĹĻŐŅŇc—űö‚∑īĎ™(y®©ng)…ķ≥…ĶńŖÄ‘≠Ą©(CO)ĆĘŤFŹńŤFĶV ĮņÔŖÄ‘≠≥ŲĀŪ(l®Ęi)°£
(2)‘≠ŃŌ£ļŤFĶV Į£ļŖxďŮĶV ĮólľĢ≥£“ä(ji®§n)ĶńŤFĶV Į”–īŇŤFĶV(÷ų“™≥…∑÷ «Fe3O4 )���°Ę≥ŗŤFĶV(÷ų“™≥…∑÷ «Fe2O3 )
ĹĻŐŅ◊ų”√£ļ(1)ŐŠĻ©łŖúō C+O2==łŖúō==CO2 (2)ŐŠĻ©CO CO2+C==łŖúō==2CO
ĮĽ“ Į£ļ◊ų”√≥ż»•SiO2CaCO3==łŖúō===CaO+CO2↑ CaO+SiO2==łŖúō===CaSiO3
(3)÷ų“™‘O(sh®®)āš£ļłŖ†t
(4)“ĪüíŖ^(gu®į)≥Ő÷–įl(f®°)…ķĶńĽĮĆW(xu®¶)∑īĎ™(y®©ng)£ļC+O2==Łc(di®£n)»ľ==CO2 CO2+C==łŖúō==2CO 3CO+Fe2O3==łŖúō==2Fe+3CO2CaCO3==łŖúō===CaO+CO2↑ CaO+SiO2==łŖúō===CaSiO3
◊Ę“‚£ļ ĮĽ“ ĮĶń÷ų“™◊ų”√ «ĆĘĶV Į÷–Ķń∂Ģ—űĽĮĻŤřD(zhu®£n)◊É?y®≠u)ť†t‘Ł�°£
üíšď‘O(sh®®)āš£ļřD(zhu®£n)†t����°ĘŽä†t°Ę∆ņt��°£
‘≠ņŪ£ļ‘ŕłŖúōólľĢŌ¬��£¨”√—űö‚ĽÚŤFĶń—űĽĮőÔį—…ķŤF÷–ňýļ¨ĶńŖ^(gu®į)ŃŅĶńŐľļÕ∆šňŁŽsŔ|(zh®¨)řD(zhu®£n)◊É?y®≠u)ťö‚ůwļÕ†t‘Ł∂Ý≥ż»•��°£C+O2==Łc(di®£n)»ľ==CO2
ŅľŁc(di®£n)14.ĹūĆŔĶńšPőgļÕĪ£◊o(h®ī)
(1)ŤF…ķšPĶńólľĢ «£ļŤFŇcO2°ĘňģĹ””|(ŤFšPĶń÷ų“™≥…∑÷£ļFe2O3•XH2O)
(„~…ķ„~ĺGĶńólľĢ£ļ„~ŇcO2���°Ęňģ���°ĘCO2Ĺ””|°£„~ĺGĶńĽĮĆW(xu®¶) Ĺ£ļCu2(OH)2CO3)
(2)ŤFĶńšPőgólľĢ£ļ”–ňģļÕ—űö‚�£¨∑ņ÷ĻŤF÷∆∆∑…ķšPĶńīŽ ©£ļĘŔĪ£≥÷ŤF÷∆∆∑ĪŪ√śĶń«ŚĚć°Ęł…‘Ô
ĘŕĪŪ√śÕŅĪ£◊o(h®ī)ń§£ļ»ÁÕŅ”Õ�°ĘňĘ∆Š°ĘŽäŚÉ��°ĘŅĺň{(l®Ęn)Ķ»
ĘŘ÷∆≥…ļŌĹū£ļ≤ĽšPšď
(3)ŤFšPļ‹ Ťň…∂ŗŅ◊�£¨≤Ľń‹◊ŤĶKņÔĆ”ĶńŤFņ^ņm(x®ī)Ňc—űö‚°Ęňģ’Űö‚∑īĎ™(y®©ng)���£¨“ÚīňŤF÷∆∆∑Ņ…“‘»ę≤ŅĪĽšPőg��°£
ŤFšPļ‹ Ťň…∂ŗŅ◊“◊őŁňģ�£¨∑ī∂ÝēĢ(hu®¨)ľ”ŅžŤFĶń…ķšP����£¨“Ú∂ÝŤF…ķšPĎ™(y®©ng)ľįēr(sh®™)≥ż»•�°£
(4)∂ÝšXŇc—űö‚∑īĎ™(y®©ng)…ķ≥…÷¬√‹Ķń—űĽĮšXĪ°ń§£¨Źń∂Ý◊Ť÷ĻšXŖM(j®¨n)“Ľ≤Ĺ—űĽĮ£¨“Úīň���£¨šXĺŖ”–ļ‹ļ√ĶńŅĻłĮőg–‘ń‹���°£
ŅľŁc(di®£n)15.Ī£◊o(h®ī)ĹūĆŔŔY‘ī
Ī£◊o(h®ī)ĹūĆŔŔY‘īĶń”––ßÕĺŹĹ£ļ(1)∑ņ÷ĻĹūĆŔĶńłĮőg(2)ŹUŇfĹūĆŔĶńĽō ’ņŻ”√(3)”–”č(j®¨)ĄĚļŌņŪĶńť_(k®°i)≤…ĶVőÔ(4)Ƨ’“ĹūĆŔĶńīķ”√∆∑
“‚Ńx£ļĻĚ(ji®¶)ľsĹūĆŔŔY‘ī£¨úp…Ŕ≠h(hu®Ęn)ĺ≥őŘ»ĺ
°°°° ög”≠ Ļ”√ ÷ôC(j®©)�°Ę∆ĹįŚĶ»“∆Ą”(d®įng)‘O(sh®®)āš‘LÜĖ(w®®n)÷–ŅľĺW(w®£ng)£¨2024÷–Ņľ“Ľ¬∑Ň„įťÕ¨––�£°>>Łc(di®£n)ďŰ≤ťŅī















