š`ģ^(q©▒)╠ßąč
1.īŹ“×╩ęųŲ╚ĪÜŌ¾wĄ─čbų├░³└©░l(f©Ī)╔·čbų├║═╩š╝»čbų├ā╔▓┐Ęų���Ż¼Ųõ▀xō±ę└ō■╚ńŽ┬Ż║
(1)ÜŌ¾w░l(f©Ī)╔·čbų├Ą─▀xō±Ż║ė╔Ę┤æ¬╬’Ą─ĀŅæB(t©żi)║═Ę┤æ¬Śl╝■üĒ┤_Č©���ĪŻó┘╚¶Ę┤æ¬╬’ų╗ėą╣╠¾w���Ż¼Ę┤æ¬ąĶę¬╝ė¤ßĢrŻ¼æ¬▀xō±Ž┬łDųą╝ū╦∙╩ŠĄ─īŹ“×čbų├�����ĪŻó┌╚¶Ę┤æ¬╬’ĀŅæB(t©żi)×ķ╣╠¾w+ę║¾w����Ż¼Ę┤æ¬▓╗ąĶę¬╝ė¤ßĢrŻ¼æ¬▀xō±łDųąęę╦∙╩Š╝░┼cų«ŽÓ╦ŲĄ─īŹ“×čbų├���ĪŻ
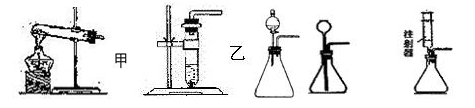
(2)ÜŌ¾w╩š╝»čbų├Ą─▀xō±Ż║ę└ō■ÜŌ¾wĄ─╬’└Ēąį┘|(╩Ūʱ╚▄ĮŌ┼c╦«��Īó├▄Č╚▒╚┐šÜŌ┤¾▀Ć╩ŪąĪ)║═╗»īWąį┘|(╩Ūʱ┼c╦«�����Īó┐šÜŌ░l(f©Ī)╔·Ę┤æ¬)üĒ▀xō±�����ĪŻ
ó┘ÜŌ¾wĄ─├▄Č╚┤¾ė┌┐šÜŌ(╗“ŽÓī”Ęųūė┘|┴┐┤¾ė┌29)�Ż¼┐╔ė├Ž“╔Ž┼┼┐šÜŌĘ©╩š╝»�ĪŻ
ó┌ÜŌ¾wĄ─├▄Č╚ąĪė┌┐šÜŌ(╗“ŽÓī”Ęųūė┘|┴┐ąĪė┌29)Ż¼┐╔ė├Ž“Ž┬┼┼┐šÜŌĘ©╩š╝»�����ĪŻ
ó█ÜŌ¾wļy╚▄ė┌╦«Ūę▓╗┼c╦«Ę┤æ¬�Ż¼┐╔ė├┼┼╦«Ę©╩š╝»ĪŻ
2.╦ÄŲĘ▀xė├æ¬ūóęŌĄ─å¢Ņ}Ż║
ó┘▓╗─▄ė├ØŌ¹}╦ß��ĪŻę“×ķØŌ¹}╦ßęūō]░l(f©Ī)���Ż¼┬╚╗»ÜõÜŌ¾węū╗ņ╚ļ«a╔·Ą─Č■č§╗»╠╝ā╚���ĪŻ
ó┌▓╗─▄ė├┴“╦ßĪŻļm╚╗┴“╦ßę▓─▄Ė·╠╝╦ßŌ}Ę┤æ¬╔·│╔Č■č§╗»╠╝Ż║H2SO4+CaCO3 = CaSO4+H2O+CO2↑ Ą½ė╔ė┌«a╬’┴“╦ßŌ}╬ó╚▄ė┌╦«��Ż¼ą╬│╔Ą─│┴ĄĒĢ■ĖĮų°į┌ēKĀŅ┤¾└Ē╩»╗“╩»╗ę╩»Ą─▒Ē├µŻ¼ūĶĄKĘ┤æ¬└^└m(x©┤)▀Mąą�Ż¼╦∙ęįīŹ“×╩ęė├┤¾└Ē╩»(╗“╩»╗ę╩»)ųŲ╚ĪČ■č§╗»╠╝ĢrŻ¼ę╗░ŃČ╝▀xė├ŽĪ¹}╦ß���ĪŻ
ó█×ķ╩╣īŹ“×čbų├Ė³║å╗»�����Ż¼ę╗░Ń▓╗ė├Ę█─®ĀŅ╠╝╦ßŌ}╗“╠╝╦ßŌcŠ¦¾w(Na2CO3+2HClĪĪ =2NaCl+H2O+CO2↑)����Ż¼Ę█─®ĀŅ╣╠¾w╗“ąĪ┴ŻĀŅŠ¦¾w╬’┘|Ą─▒Ē├µĘe┤¾�Ż¼┼c╦ßĘ┤æ¬╦┘┬╩╠½┐ņĪŻ
3.Üw╝{┐éĮYīŹ“×╩ęųŲ╚ĪÜŌ¾wĄ─╦╝┬Ę║═ĘĮĘ©Ż║
ÜŌ¾wĄ─īŹ“×╩ęųŲ╚ĪĄ─ę╗░Ń╦╝┬Ę║═ĘĮĘ©×ķŻ║╩ūŽ╚ę¬čąŠ┐ÜŌ¾wīŹ“×╩ęųŲ╚ĪĄ─╗»īWĘ┤æ¬įŁ└Ē����Ż¼╝┤▀xō±║Ž▀mĄ─Ę┤æ¬╬’║═Ę┤æ¬Śl╝■(╚ń│Ż£žĪó╝ė¤ß�����Īó╝ė┤▀╗»ä®Ą╚)���Ż¼▀Ćę¬▀xō±║Ž▀mĄ─īŹ“×čbų├�����Ż¼▓óąĶ蹊┐╚ń║╬“×ūCųŲĄ├Ą─ÜŌ¾wŠ═╩Ū╦∙ę¬ųŲĄ─ÜŌ¾w�ĪŻ
(1)▀xō±Ę┤æ¬ĢrŻ¼ę¬┐╝æ]įŁ┴ŽęūĄ├�Ż¼Ę┤æ¬Śl╝■ę¬Ū¾▓╗Ė▀��Ż¼▓┘ū„║å▒Ń░▓╚½���Ż¼Ę┤æ¬╦┘┬╩▀mųą����Ż¼╔·│╔ÜŌ¾w▓╗╗ņ╚ļŲõ╦¹ÜŌ¾w���Ż¼▒Ńė┌╩š╝»��ĪŻ
(2)īŹ“×╩ęųŲ╚ĪÜŌ¾wĄ─čbų├░³└©░l(f©Ī)╔·čbų├║═╩š╝»čbų├ā╔▓┐Ęų�����ĪŻ▀xō±ÜŌ¾w░l(f©Ī)╔·čbų├ę¬Ė∙ō■Ę┤æ¬╬’Ą─ĀŅæB(t©żi)║═Ę┤æ¬Śl╝■;▀xō±ÜŌ¾wĄ─╩š╝»čbų├æ¬┐╝æ]ÜŌ¾wĄ─├▄Č╚║═ÜŌ¾wĄ─╚▄ĮŌąį╝░ÜŌ¾w╩Ūʱ┼c╦«Ę┤æ¬��ĪŻ
(3)“×ūCÜŌ¾wĢr�Ż¼īŹ“×¼FŽ¾ę¬├„’@ĪŻ
ĪŠĄõą═└²Ņ}Ī┐
└²╬÷Ż║
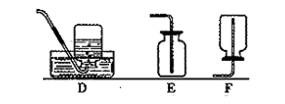
¼Fė├┤¾└Ē╩»║═ŽĪ¹}╦ßųŲ╚ĪČ■č§╗»╠╝ÜŌ¾w(╚ńłD╩Š)Ż║

(1)īæ│÷įōĘ┤æ¬Ą─╗»īWĘĮ│╠╩ĮŻ║____________�����ĪŻ
(2)Ž┬łD╩ŪųŲ╚ĪČ■č§╗»╠╝Ą─čbų├łD����Ż¼ųĖ│÷łDųąąĪįć╣▄AĄ─ū„ė├Ż║____________ĪŻ
(3)į§śė┼ąöÓ╝»ÜŌŲ┐ųąęč╝»ØMČ■č§╗»╠╝ÜŌ¾w?____________�ĪŻ
ĮŌ╬÷Ż║
▒ŠŅ}┐╝▓ķCO2Ą─īŹ“×ųŲĘ©Ż¼┐╔Ė∙ō■ŲõĘ┤æ¬įŁ└Ē���Īó“×ØMĘĮĘ©�����ĪóūóęŌ╩┬ĒŚüĒĮŌ┤�����ĪŻ
(1)įōĘ┤æ¬Ą─╗»īWĘĮ│╠╩ĮCaCO3+2HCl©T©TCaCl2+H2O + CO2↑╝┤×ķīŹ“×╩ęųŲCO2Ą─Ę┤æ¬įŁ└Ē�ĪŻ
(2)ė^▓ņłD╩Š��Ż¼┬ō(li©ón)ŽļūóęŌå¢Ņ}�Ż¼┐╔░l(f©Ī)¼FąĪįć╣▄Ą─ū„ė├æ¬╩Ū╩╣ķLŅi┬®ČĘĄ──®Č╦ą╬│╔ę║ĘŌ����Ż¼Ę└ų╣╔·│╔Ą─Č■č§╗»╠╝ÜŌ¾wę▌│÷���ĪŻ
(3)CO2Ą─“×ØMæ¬ė├╚╝ų°Ą─ąĪ─ŠŚlĘ┼į┌Ų┐┐┌�Ż¼╚¶─ŠŚlŽ©£ń��Ż¼ätūC├„ęčØM┴╦��ĪŻ
┤░ĖŻ║
(1)CaCO3+2HCl©T©TCaCl2+H2O + CO2↑
(2)ę║ĘŌ�Ż¼Ę└ų╣Č■č§╗»╠╝ÜŌ¾wÅ─ķLŅi┬®ČĘųąę▌│÷
(3)īóę╗╚╝ų°Ą──ŠŚl╔ņĄĮ╝»ÜŌŲ┐┐┌�����Ż¼╚¶─ŠŚl╗赎©£ń��Ż¼ätÜŌ¾węč╝»ØM�ĪŻ












